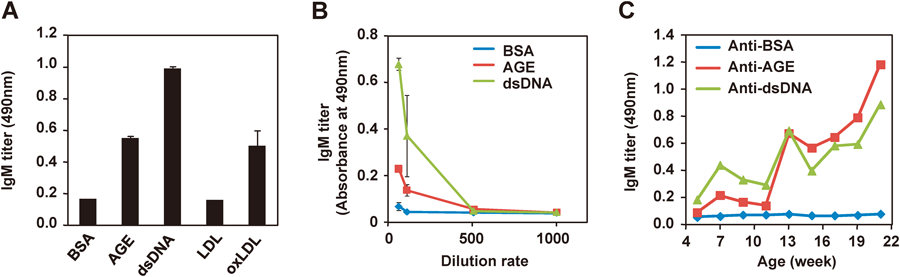
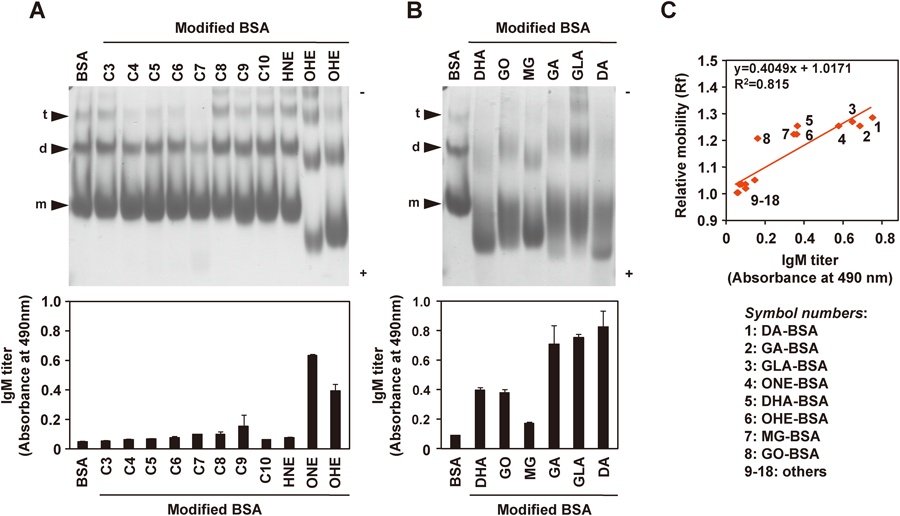
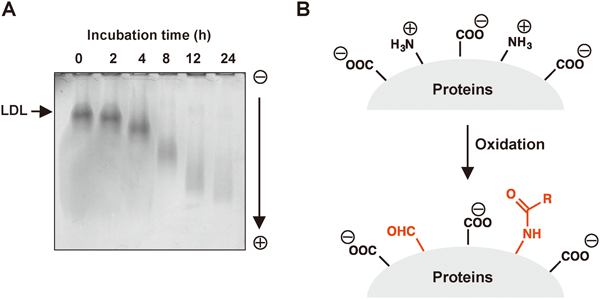
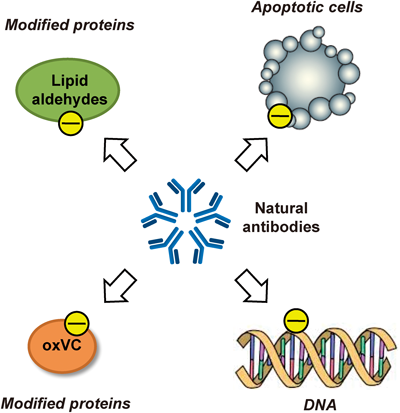
内因性抗原としての陰性荷電分子の生成と制御Formation and regulation of electronegative molecules as an endogenous antigen
名古屋大学大学院生命農学研究科Graduate School of Bioagricultural Sciences, Nagoya University ◇ 〒464-8601 愛知県名古屋市千種区不老町Furo-cho, Chikusa-ku, Nagoya-shi, Aichi 464-8601, Japan