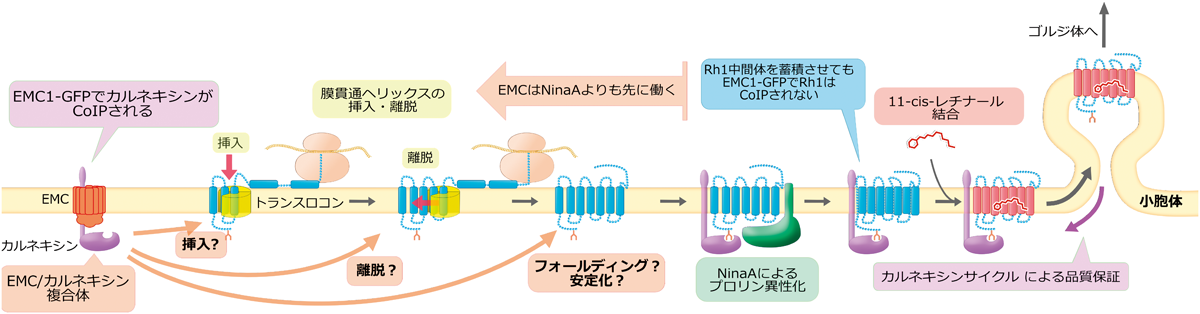
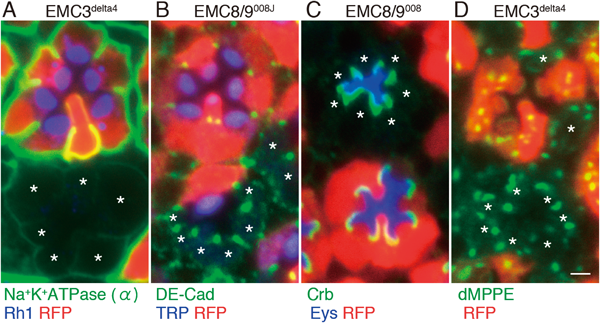
EMCは複数膜貫通タンパク質の合成に特異的に必要な因子であるEMC is essential for biosynthesis of rhodopsin and other multi-pass membrane proteins in Drosophila photoreceptors
1 広島大学大学院総合科学研究科行動科学研究室Laboratory of Behavioral Sciences, Graduate School of Integrated Arts and Sciences, Hiroshima University ◇ 〒739-8521 広島県東広島市鏡山一丁目7番1号Kagamiyama 1-7-1, Higashi-Hiroshima-shi, Hiroshima 739-8521, Japan
2 広島大学大学院総合科学研究科人間科学部門Division of Human Sciences, Graduate School of Integrated Arts and Sciences, Hiroshima University ◇ 〒739-8521 広島県東広島市鏡山一丁目7番1号Kagamiyama 1-7-1, Higashi-Hiroshima-shi, Hiroshima 739-8521, Japan