1) Stam, N.J., Spits, H., & Ploegh, H.L. (1986) J. Immunol., 137, 2299–2306.
2) Jiang, Y., Arase, N., Kohyama, M., Hirayasu, K., Suenaga, T., Jin, H., Matsumoto, M., Shida, K., Lanier, L.L., Saito, T., & Arase, H. (2013) Int. Immunol., 25, 235–246.
5) Ghosh, P., Amaya, M., Mellins, E., & Wiley, D.C. (1995) Nature, 378, 457–462.
6) Meusser, B., Hirsch, C., Jarosch, E., & Sommer, T. (2005) Nat. Cell Biol., 7, 766–772.
7) Dorner, T., Egerer, K., Feist, E., & Burmester, G.R. (2004) Curr. Opin. Rheumatol., 16, 246–253.
8) Jin, H., Arase, N., Hirayasu, K., Kohyama, M., Suenaga, T., Saito, F., Tanimura, K., Matsuoka, S., Ebina, K., Shi, K., Toyama-Sorimachi, N., Yasuda, S., Horita, T., Hiwa, R., Takasugi, K., Ohmura, K., Yoshikawa, H., Saito, T., Atsumi, T., Sasazuki, T., Katayama, I., Lanier, L.L., & Arase, H. (2014) Proc. Natl. Acad. Sci. USA, 111, 3787–3792.
9) Tanimura, K., Jin, H., Suenaga, T., Morikami, S., Arase, N., Kishida, K., Hirayasu, K., Kohyama, M., Ebina, Y., Yasuda, S., Horita, T., Takasugi, K., Ohmura, K., Yamamoto, K., Katayama, I., Sasazuki, T., Lanier, L.L., Atsumi, T., Yamada, H., & Arase, H. (2015) Blood, 125, 2835–2844.
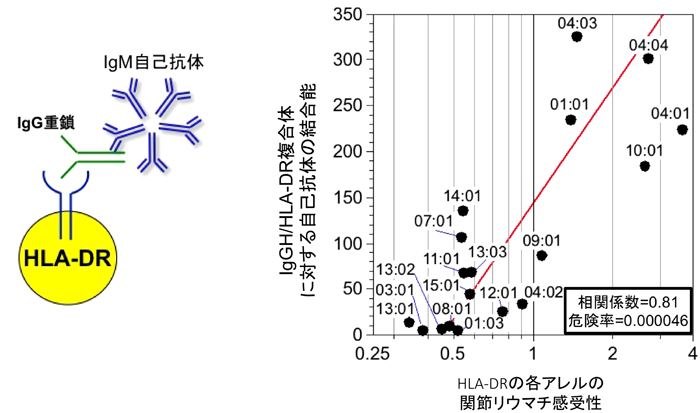
10) Raychaudhuri, S., Sandor, C., Stahl, E.A., Freudenberg, J., Lee, H.S., Jia, X., Alfredsson, L., Padyukov, L., Klareskog, L., Worthington, J., Siminovitch, K.A., Bae, S.C., Plenge, R.M., Gregersen, P.K., & de Bakker, P.I. (2012) Nat. Genet., 44, 291–296.