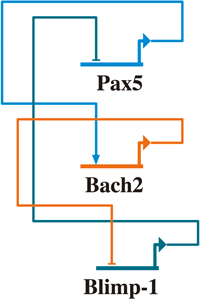
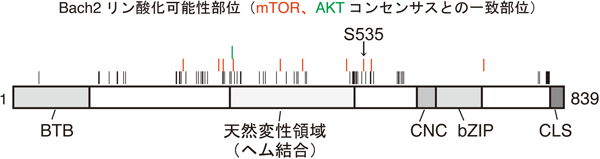
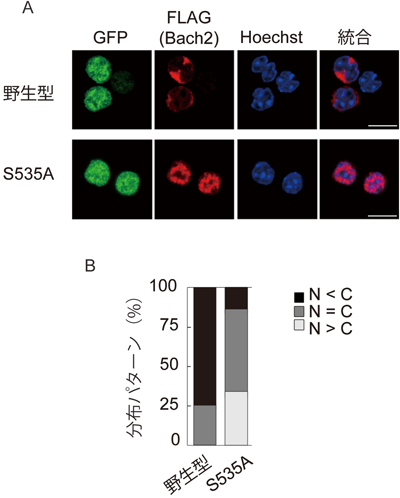
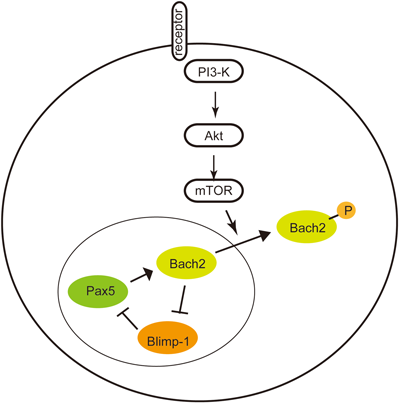
1) Itoh-Nakadai, A., Hikota, R., Muto, A., Kometani, K., Watanabe-Matsui, M., Sato, Y., Kobayashi, M., Nakamura, A., Miura, Y., Yano, Y., Tashiro, S., Sun, J., Ikawa, T., Ochiai, K., Kurosaki, T., & Igarashi, K. (2014) Nat. Immunol., 15, 1171–1180.
2) Kato, L., Stanlie, A., Begum, N.A., Kobayashi, M., Aida, M., & Honjo, T. (2012) J. Immunol., 188, 3559–3566.
3) Muto, A., Tashiro, S., Nakajima, O., Hoshino, H., Takahashi, S., Sakoda, E., Ikebe, D., Yamamoto, M., & Igarashi, K. (2004) Nature, 429, 566–571.
4) Muto, A., Ochiai, K., Kimura, Y., Itoh-Nakadai, A., Calame, K.L., Ikebe, D., Tashiro, S., & Igarashi, K. (2010) EMBO J., 29, 4048–4061.
5) Roychoudhuri, R., Hirahara, K., Mousavi, K., Clever, D., Klebanoff, C.A., Bonelli, M., Sciume, G., Zare, H., Vahedi, G., Dema, B., Yu, Z., Liu, H., Takahashi, H., Rao, M., Muranski, P., Crompton, J.G., Punkosdy, G., Bedognetti, D., Wang, E., Hoffmann, V., Rivera, J., Marincola, F.M., Nakamura, A., Sartorelli, V., Kanno, Y., Gattinoni, L., Muto, A., Igarashi, K., O’Shea, J.J., & Restifo, N.P. (2013) Nature, 498, 506–510.
6) Tsukumo, S., Unno, M., Muto, A., Takeuchi, A., Kometani, K., Kurosaki, T., Igarashi, K., & Saito, T. (2013) Proc. Natl. Acad. Sci. USA, 110, 10735–10740.
7) Kuwahara, M., Suzuki, J., Tofukuji, S., Yamada, T., Kanoh, M., Matsumoto, A., Maruyama, S., Kometani, K., Kurosaki, T., Ohara, O., Nakayama, T., & Yamashita, M. (2014) Nat. Commun., 5, 3555.
9) Ando, R., Shima, H., Tamahara, T., Sato, Y., Watanabe-Matsui, M., Kato, H., Sax, N., Motohashi, H., Taguchi, K., Yamamoto, M., Nio, M., Maeda, T., Ochiai, K., Muto, A., & Igarashi, K. (2016) J. Biol. Chem., 291, 1826–1840.
13) Beltrao, P., Albanese, V., Kenner, L.R., Swaney, D.L., Burlingame, A., Villen, J., Lim, W.A., Fraser, J.S., Frydman, J., & Krogan, N.J. (2012) Cell, 150, 413–425.
14) Watanabe-Matsui, M., Matsumoto, T., Matsui, T., Ikeda-Saito, M., Muto, A., Murayama, K., & Igarashi, K. (2015) Arch. Biochem. Biophys., 565, 25–31.
15) Watanabe-Matsui, M., Muto, A., Matsui, T., Itoh-Nakadai, A., Nakajima, O., Murayama, K., Yamamoto, M., Ikeda-Saito, M., & Igarashi, K. (2011) Blood, 117, 5438–5448.
17) Hoshino, H., Kobayashi, A., Yoshida, M., Kudo, N., Oyake, T., Motohashi, H., Hayashi, N., Yamamoto, M., & Igarashi, K. (2000) J. Biol. Chem., 275, 15370–15376.
18) Suzuki, A., Kaisho, T., Ohishi, M., Tsukio-Yamaguchi, M., Tsubata, T., Koni, P.A., Sasaki, T., Mak, T.W., & Nakano, T. (2003) J. Exp. Med., 197, 657–667.