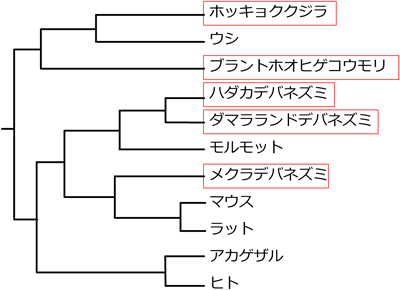
3) Kim, E.B., Fang, X., Fushan, A.A., Huang, Z., Lobanov, A.V., Han, L., Marino, S.M., Sun, X., Turanov, A.A., Yang, P., Yim, S.H., Zhao, X., Kasaikina, M.V., Stoletzki, N., Peng, C., Polak, P., Xiong, Z., Kiezun, A., Zhu, Y., Chen, Y., Kryukov, G.V., Zhang, Q., Peshkin, L., Yang, L., Bronson, R.T., Buffenstein, R., Wang, B., Han, C., Li, Q., Chen, L., Zhao, W., Sunyaev, S.R., Park, T.J., Zhang, G., Wang, J., & Gladyshev, V.N. (2011) Nature, 479, 223–227.
4) Fang, X., Seim, I., Huang, Z., Gerashchenko, M.V., Xiong, Z., Turanov, A.A., Zhu, Y., Lobanov, A.V., Fan, D., Yim, S.H., Yao, X., Ma, S., Yang, L., Lee, S.-G., Kim, E.B., Bronson, R.T., Šumbera, R., Buffenstein, R., Zhou, X., Krogh, A., Park, T.J., Zhang, G., Wang, J., & Gladyshev, V.N. (2014) Cell Reports, 8, 1354–1364.
10) Pérez, V.I., Buffenstein, R., Masamsetti, V., Leonard, S., Salmon, A.B., Mele, J., Andziak, B., Yang, T., Edrey, Y., Friguet, B., Ward, W., Richardson, A., & Chaudhuri, A. (2009) Proc. Natl. Acad. Sci. USA, 106, 3059–3064.
11) Lewis, K.N., Wason, E., Edrey, Y.H., Kristan, D.M., Nevo, E., & Buffenstein, R. (2015) Proc. Natl. Acad. Sci. USA, 112, 3722–3727.
12) Pride, H., Yu, Z., Sunchu, B., Mochnick, J., Coles, A., Zhang, Y., Buffenstein, R., Hornsby, P.J., Austad, S.N., & Pérez, V.I. (2015) Biochem. Biophys. Res. Commun., 457, 669–675.
16) Triplett, J.C., Tramutola, A., Swomley, A., Kirk, J., Grimes, K., Lewis, K., Orr, M., Rodriguez, K., Cai, J., Klein, J.B., Perluigi, M., Buffenstein, R., & Allan Butterfield, D. (2015) Basis Dis., 1852, 2213–2224.
26) Jourdain, A.A., Koppen, M., Rodley, C.D., Maundrell, K., Gueguen, N., Reynier, P., Guaras, A.M., Enriquez, J.A., Anderson, P., Simarro, M., & Martinou, J.-C. (2015) Cell Reports, 10, 1110–1121.
31) Seim, I., Fang, X., Xiong, Z., Lobanov, A.V., Huang, Z., Ma, S., Feng, Y., Turanov, A.A., Zhu, Y., Lenz, T.L., Gerashchenko, M.V., Fan, D., Hee Yim, S., Yao, X., Jordan, D., Xiong, Y., Ma, Y., Lyapunov, A.N., Chen, G., Kulakova, O.I., Sun, Y., Lee, S.-G., Bronson, R.T., Moskalev, A.A., Sunyaev, S.R., Zhang, G., Krogh, A., Wang, J., & Gladyshev, V.N. (2013) Nat. Commun., 4, 2212.
33) Zhang, G., Cowled, C., Shi, Z., Huang, Z., Bishop-Lilly, K.A., Fang, X., Wynne, J.W., Xiong, Z., Baker, M.L., Zhao, W., Tachedjian, M., Zhu, Y., Zhou, P., Jiang, X., Ng, J., Yang, L., Wu, L., Xiao, J., Feng, Y., Chen, Y., Sun, X., Zhang, Y., Marsh, G.A., Crameri, G., Broder, C.C., Frey, K.G., Wang, L.-F., & Wang, J. (2013) Science, 339, 456–460.
34) Keane, M., Semeiks, J., Webb, A.E., Li, Y.I., Quesada, V., Craig, T., Madsen, L.B., van Dam, S., Brawand, D., Marques, P.I., Michalak, P., Kang, L., Bhak, J., Yim, H.-S., Grishin, N.V., Nielsen, N.H., Heide-Jørgensen, M.P., Oziolor, E.M., Matson, C.W., Church, G.M., Stuart, G.W., Patton, J.C., George, J.C., Suydam, R., Larsen, K., López-Otín, C., O’Connell, M.J., Bickham, J.W., Thomsen, B., & de Magalhães, J.P. (2015) Cell Reports, 10, 112–122.
35) Seim, I., Ma, S., Zhou, X., Gerashchenko, M.V., Lee, S.G., Suydam, R., George, J.C., Bickham, J.W., & Gladyshev, V.N. (2014) Aging, 6, 879–899.
38) Shaffer, H.B., Minx, P., Warren, D.E., Shedlock, A.M., Thomson, R.C., Valenzuela, N., Abramyan, J., Amemiya, C.T., Badenhorst, D., Biggar, K.K., Borchert, G.M., Botka, C.W., Bowden, R.M., Braun, E.L., Bronikowski, A.M., Bruneau, B.G., Buck, L.T., Capel, B., Castoe, T.A., Czerwinski, M., Delehaunty, K.D., Edwards, S.V., Fronick, C.C., Fujita, M.K., Fulton, L., Graves, T.A., Green, R.E., Haerty, W., Hariharan, R., Hernandez, O., Hillier, L.W., Holloway, A.K., Janes, D., Janzen, F.J., Kandoth, C., Kong, L., de Koning, A.J., Li, Y., Literman, R., McGaugh, S.E., Mork, L., O’Laughlin, M., Paitz, R.T., Pollock, D.D., Ponting, C.P., Radhakrishnan, S., Raney, B.J., Richman, J.M., St John, J., Schwartz, T., Sethuraman, A., Spinks, P.Q., Storey, K.B., Thane, N., Vinar, T., Zimmerman, L.M., Warren, W.C., Mardis, E.R., & Wilson, R.K. (2013) Genome Biol., 14, R28.