植物の本質とは,「緑色で動かないこと」であるといわれる.これは,植物が光合成という仕組みを持った独立栄養生物であることと,巧みな環境適応の仕組みを持つ生き物であることを意味している.脂質の植物生理学の見地からは,光合成の場である葉緑体でスフィンゴ脂質が見つからないことから,葉緑体チラコイド膜での光化学反応,あるいは,葉緑体包膜での物質の輸送にスフィンゴ脂質が何らかの働きをしているとは考えにくい.一方,植物の環境適応の仕組みに関するスフィンゴ脂質の役割については,1)生体膜機能の恒常性維持に関連して,低温ストレスやアルミニウムストレスにおけるスフィンゴ脂質の不飽和化や1, 2),2)細胞の情報伝達に関連して,スフィンゴ脂質代謝産物が気孔孔辺細胞の開閉の制御に関与することが報告されている3–5).なお,植物スフィンゴ脂質の生理機能の詳細については,他の総説を参照されたい6–10).
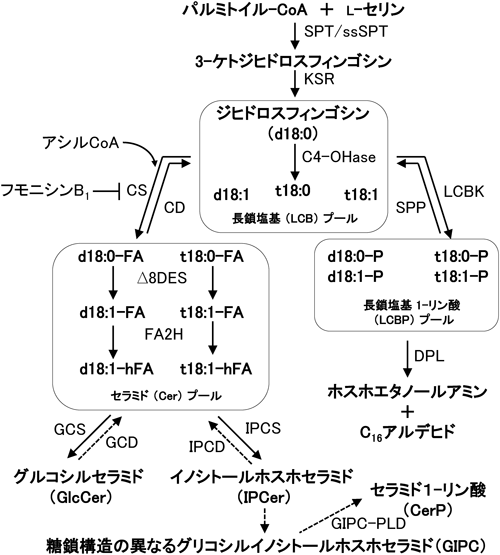
スフィンゴ脂質は,スフィンゴイドと呼ばれる長鎖塩基(long-chain base,以下LCBと略す)を基本骨格に持つ一群の脂質の総称である.L-セリンとパルミトイルCoAの縮合反応から,セラミド合成に至るステップは,動物や酵母におけるスフィンゴ脂質の生合成反応と変わらない(図1).なお,本稿では,LCBのアミノ基にアシル基がアミド結合したもの(N-アシルスフィンゴイド)を総称してセラミド(Cer)と呼ぶ.2000年代に入り,植物のスフィンゴ脂質代謝に関わる酵素遺伝子の解析は,主としてモデル実験植物であるシロイヌナズナ(Arabidopsis thaliana)を用いて行われてきた.特にこの10年間で,スフィンゴ脂質の生合成に関与するほとんどすべての合成酵素遺伝子がクローニングされ,これらの遺伝子に関するノックアウト株またはノックダウン株の解析によって,植物におけるスフィンゴ脂質の生理機能の研究が大きく進んだ.たとえば,スフィンゴ脂質生合成の第一段階を担うセリンパルミトイルトランスフェラーゼ(SPT)は,動物や酵母と同様にLCB1とLCB2という二つのサブユニットにより構成されるが,LCB1またはLCB2の欠損は胚性致死となることが確認され,スフィンゴ脂質は,植物においても必須な生体物質であることが明らかになった.また,シロイヌナズナ研究の流れに呼応するように,質量分析技術の進歩に伴った植物スフィンゴ脂質の網羅的分析法が報告され11, 12),代謝欠損変異株による解析は,スフィンゴ脂質とその中間代謝産物の生理的役割を明らかにするための重要な手がかりを提供している.
これまでの研究から,スフィンゴ脂質が植物の生存にとって必須な要素であることはわかったが,植物スフィンゴ脂質が持つ構造多様性の生理的意味はどのようなものであろうか? この問いにアプローチするために,本稿では,まず植物スフィンゴ脂質の構造と,その多様性をもたらす代謝酵素に関する最近の知見を概説し,その後,これまでに筆者らの研究室で蓄積した植物スフィンゴ脂質の構成成分のデータを紹介しながら,植物スフィンゴ脂質が持つ構造多様性を解析するための液体クロマトグラフィー・タンデム質量分析(LC-MS/MS)による分析法について述べたい.
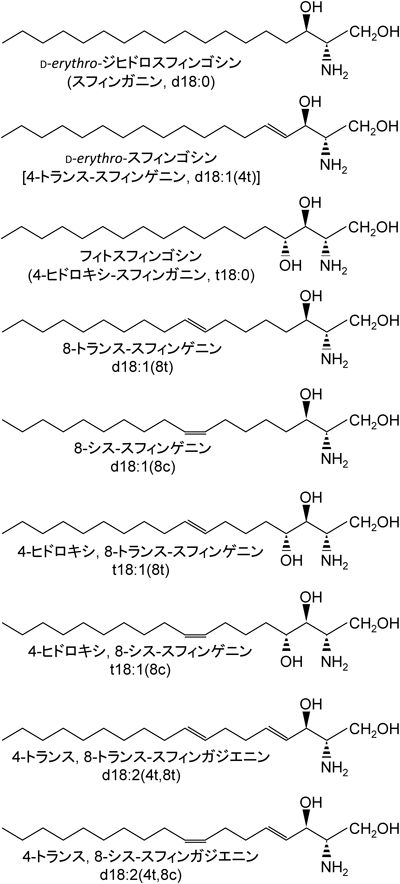
植物のスフィンゴ脂質を構成するLCBとして見つかっているものは,スフィンゴシン[4-トランス-スフィンゲニン,d18:1(4t)],ジヒドロスフィンゴシン(スフィンガニン,d18:0),フィトスフィンゴシン(t18:0)の他に,8-不飽和(シスまたはトランス)型のLCBである(図2)13).また,図2に示したもの以外に,微量ではあるものの,トウモロコシからスフィンガトリエニン(d18:3)が報告されている14, 15).
現在まで,植物スフィンゴ脂質の構成LCBとしては,炭素鎖長がC18のものしか見つかっていない.これは,LCB合成の第一段階を担うSPTのパルミトイルCoA(16:0-CoA)に対する厳密な基質特異性を反映しているものと思われる(図1).SPTはそれぞれ50から70 kDaのLCB1とLCB2からなるヘテロ二量体で構成されるが16–18),これらのサブユニットは,SPT活性の調節に関わるいくつかのタンパク質とも複合体を形成しているようである19).実際に複合体を形成しているかは不明だが,SPTのアシルCoAに対するアシル鎖選択性を決定する要因の一つは,小サブユニットSPT(small subunits of SPT,以下ssSPTと略す)と呼ばれるSPT活性を高める比較的短いポリペプチドが関連しており,この数十個からなるポリペプチド中のたった1個のアミノ酸の違いによるものではないかと筆者らは考えている.酵母Δlcb1Δlcb2二重変異株の高温感受性を相補するヒトのcDNAから単離されたssSPTaとssSPTbについて,ssSPTaによるSPTアッセイの実験では主としてC18のLCBが生じるのに対し,ssSPTbを用いた実験ではC18の他にC20のLCBが生じると報告されている20).その後,シロイヌナズナで,ヒトssSPTのホモログと思われるポリペプチドが2個同定され,ヒトssSPTのアミノ酸配列と比較した結果,ヒトssSPTbだけがメチオニンではなく,バリンとなっている部位が発見された.そこで,シロイヌナズナssSPTにおけるこの位置のメチオニンをバリンに置換してSPTアッセイを行ったところ,C20のLCBが生じることがわかった19).実際に,データベース上で植物のssSPTと思われるポリペプチドのアミノ酸配列を調べてみたところ,興味深いことに,このメチオニンが植物で例外なく保存されていることがわかった.
近年,シロイヌナズナで,セラミド合成酵素(LOH1, LOH2, LOH3)が単離され,このうちLOH2は,16:0-CoAに対する基質特異性が高いが,ジヒドロキシ型とトリシヒドロキシ型の両方のLCBを基質とすることが報告された21, 22).LCBのC-8, 9位間の不飽和化とアシル鎖のα位での水酸化は,セラミドの段階で起こる23–25).LCBのC-8不飽和化酵素の遺伝子が欠損したシロイヌナズナ突然変異株の解析によって,8-シス不飽和LCBを持つセラミドは,主として(モノ)グルコシルセラミド(GlcCer)へ変換されることが示唆されている.また,8-不飽和LCBを持たないシロイヌナズナの突然変異株は,致死ではないが矮性となり,低温ストレスに対して弱くなることが報告されている23).さらに,C-8不飽和化酵素の遺伝子のうちの一つAtSLD1は,さまざまな非生物的ストレスの中でも,特に低温ストレスによって誘導される23).
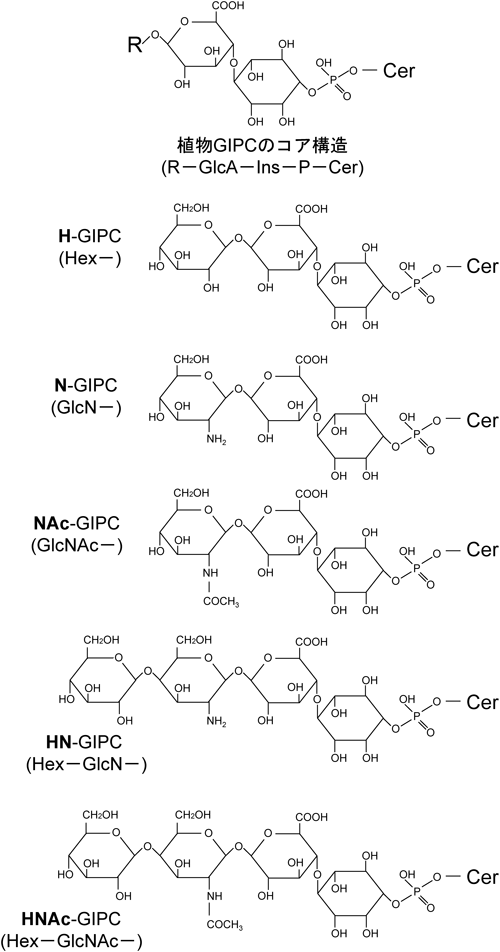
セラミドへのグルコースの転移反応は,小胞体で起こるが,グルコース転移酵素の基質はUDP-グルコースではなく,ステリルグルコシドであるとされている26).また,GlcCerを持たないシロイヌナズナの突然変異株についても,致死ではないが矮性となることが知られている23).一方,t18:0や8-トランス不飽和LCBを持つセラミドは,主としてゴルジ体でイノシトールホスホセラミド(IPC)となり23),さらにグルクロン酸が転移された後,いくつかの糖鎖が付加されてグリコシルイノシトールホスホセラミド(GIPC)になる(図3).IPCの合成は,IPC合成酵素(IPCS)によって触媒されるが,植物のIPCSは,酵母のIPCSとして同定されているAUR127)とアミノ酸配列レベルでの相同性がない.そのため,植物のIPCS遺伝子に関する研究が遅れていたが,2006年に原生動物のリーシュマニア(Leishmania major)より酵母AUR1のオーソログが単離されたことで28),リーシュマニアIPCSの情報からシロイヌナズナのIPCSも見つかった29).このシロイヌナズナIPCSは,もともとERH1として植物病原菌に対する抵抗性遺伝子RPW8の解析の中から発見されていた30).これにより,セラミド分子が植物の病原菌感染に対する抵抗反応に関与することが示唆されている.また最近,IPCにグルクロン酸を転移させる酵素IPUT1の遺伝子もシロイヌナズナより単離され,IPUT1は花粉の機能に関係することが報告されている31).GIPCの抽出画分の構成成分の分析の結果と,LC-MS/MS分析の結果を総合すると,図3に示すようなGIPCが主として存在すると思われる.
スフィンゴ脂質代謝系の分解系に関与する長鎖塩基1-リン酸(LCBP)は,LCBキナーゼ(LCBK)によって合成され,LCBPホスファターゼ(SPP)により脱リン酸化されてLCBにリサイクルされるか,もしくはLCBPリアーゼ(DPL)によりC16アルデヒドとホスホエタノールアミンに分解される.したがって,生体内におけるLCBPのレベルは,これらLCBPの合成系と分解系に働く酵素の相対活性によって制御されていると考えられる32–35).興味深いことに,シロイヌナズナのLCBPリアーゼ遺伝子(DPL1)は,老化した葉で強く発現している.また最近,緑化していないキャベツの茎や葉で,GIPC特異的なホスホリパーゼD活性により,セラミド1-リン酸が生じることが報告されている36).
3. グルコシルセラミド(GlcCer)の構成成分の植物間比較
植物から細胞膜を単離し,クロロホルム/メタノール混液で抽出される脂質を分析してみると,ステロール脂質とともにGlcCerが膜脂質全体の約1割程度存在することが報告されている37).したがって,細胞膜の脂質成分として,GlcCerが何らかの重要な機能を持つことが示唆されてきた.1980年代,帯広畜産大学の藤野教授の研究室におられた大西正男先生らによって,農作物に含まれるスフィンゴ脂質の構造的特徴が報告された.それによると,1)GlcCerのLCB部分の種類と構造が,植物に存在する他のスフィンゴ脂質のLCB部分と比較して複雑であること,2)GlcCerは,α位が水酸化されたアシル基(2-ヒドロキシアシル基)を主成分とすること,3)スフィンゴ脂質におけるLCBの炭素数はC18であること,4)スフィンゴ脂質におけるセラミド部分のアシル基とLCBの組み合わせには規則性があることが報告された38, 39).そこで,筆者らの研究室では,長年にわたってこのような特徴がさまざまな植物の緑葉で一般的に認められるのかを調べてきた.本節では,緑葉におけるGlcCerのアシル基部分の解析結果と,GlcCerのLCB部分の解析結果について概説するとともに,アシル基部分またはLCB部分の不飽和化に関する酵素遺伝子についても簡単に紹介する.
1)GlcCerの脂肪酸組成
GlcCerのアシル基部分についてみると,全体の9割以上を2-ヒドロキシ脂肪酸が占めていることがわかった.図4は,緑葉のGlcCerの2-ヒドロキシ脂肪酸の組成を示している.例外もあるが,調べた植物に共通して存在する脂肪酸としては,2-ヒドロキシリグノセリン酸(24h:0)と2-ヒドロキシベヘン酸(22h:0)である.また,イネ科植物以外では,一般的に2-ヒドロキシパルミチン酸(16h:0)を主成分としている.興味深いことに,イネ科植物については,イチゴツナギ亜科を除いて,2-ヒドロキシアラキジン酸(20h:0)を比較的多く持っているが,なぜこれらの植物に16h:0がほとんどなく,対照的に20h:0を比較的多く持っているのかは不明である.2-ヒドロキシネルボン酸(24h:1,シス-n-9)は,アブラナ科植物のシロイヌナズナやイネ科イチゴツナギ亜科のコムギで見つかっていた40).そこで,アブラナ科8種,イネ科36種を含む約70種の植物について,24h:1の有無を調べたところ,注目すべきことに,24h:1は寒冷地に適応した植物に属するアブラナ科とイチゴツナギ亜科の植物に見つかる特徴的な成分であることがわかった41–43).24h:1以外に見つかる不飽和脂肪酸としては,2-ヒドロキシドコセン酸(22h:1, n-9)や2-ヒドロキシヘキサコセン酸(26h:1, n-9)で,いずれもn-9のモノ不飽和脂肪酸である.したがって,これらの極長鎖脂肪酸は,モノ不飽和脂肪酸が鎖長伸長によって生じるのではなく,飽和型の極長鎖アシルCoAを基質とするn-9不飽和化酵素の働きによって生じると考えられる.最近,アシルCoA n-9不飽和化酵素の遺伝子(AtADS2)がシロイヌナズナで解析され,スフィンゴ脂質に存在する24h:1については,AtADS2が関与しているようである44).また,低温処理によりAtADS2の発現が誘導される.今後,植物における細胞膜の低温適応の観点から,GlcCerの構成脂肪酸の不飽和化に関連した低温耐性作物の作出研究への応用にも期待される.
2)GlcCerのLCB組成
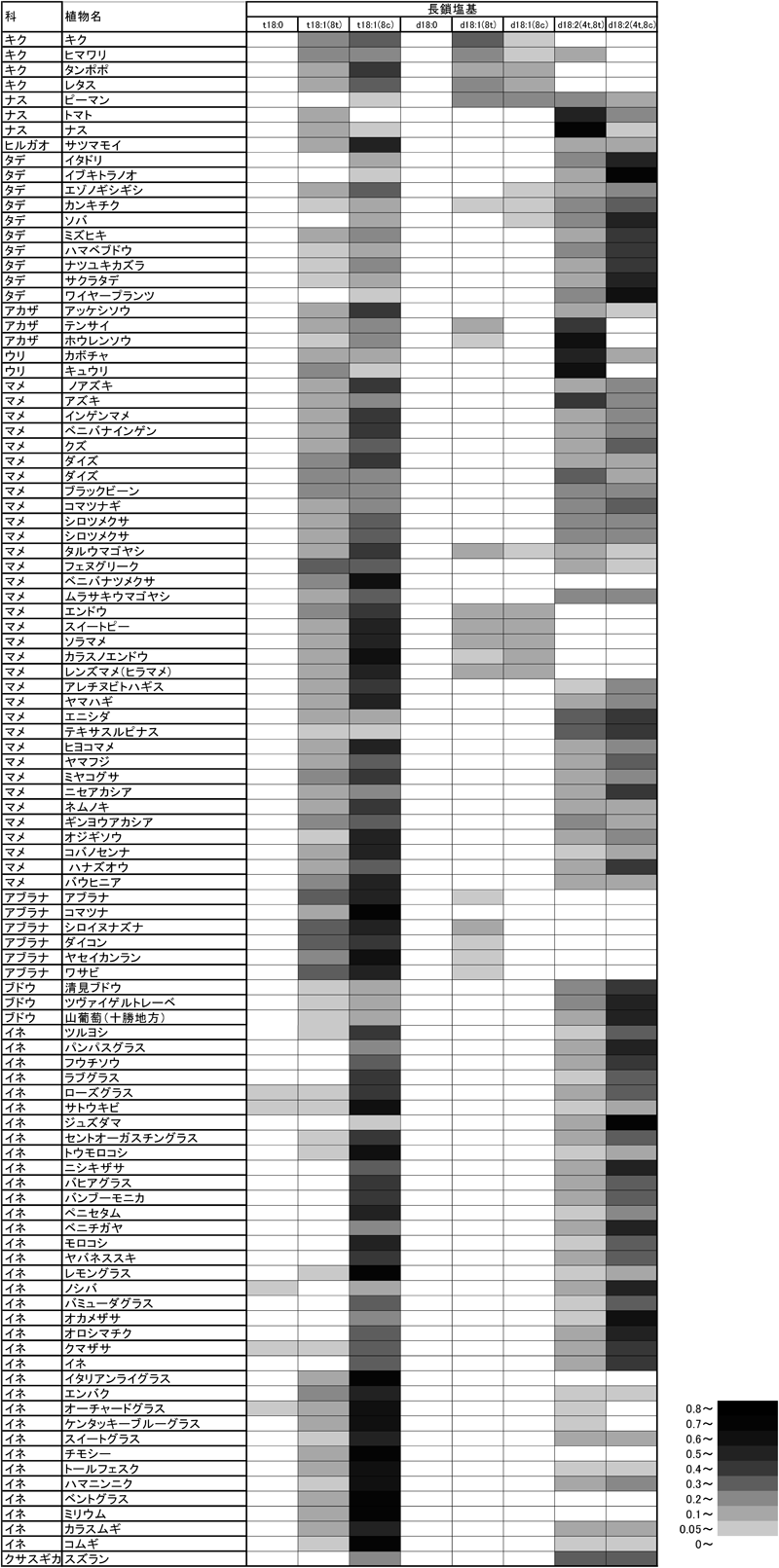
図5は,緑葉におけるGlcCerのLCBの組成を示している.調べた植物に共通して存在するLCBとしては,t18:1(8c)またはt18:1(8t)である.一方,飽和型LCB(d18:0とt18:0)は非常に少ないことがわかる.ジヒドロキシ型LCBについては,アブラナ科植物やマメ科ソラマメ連でd18:2(4t,8c)またはd18:2(4t,8t)がほとんど検出されない.そのかわりに,d18:1(8c)またはd18:1(8t)が検出される13, 41, 42).これらの植物の多くは,地中海沿岸地帯から西アジアを中心に分布しており,このLCBに関する知見は,植物地理の観点からも興味深い.アブラナ科植物であるシロイヌナズナの最近の研究で,LCBのC-4不飽和化酵素の遺伝子は,花で弱く発現しているが,葉では発現していないことが報告されている45).
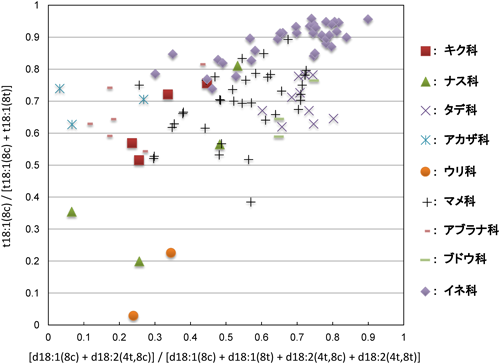
緑葉に存在するGlcCerの8-不飽和型LCBの8-シス型と8-トランス型の割合を図6に示す.なお,横軸は,8-不飽和型のジヒドロキシLCB分子(4種類)全体に占める8-シス型の割合を示しており,縦軸は,8-不飽和型のトリヒドロキシLCB全体に占める8-シス型の割合を示している.イネ科やタデ科は,ジヒドロキシLCBとトリヒドロキシLCBともにシス型が多かった.一方,調べた試料数は少ないものの,ウリ科やナス科では,ジヒドロキシLCBとトリヒドロキシLCBともにトランス型が多い傾向を示した.また,ジヒドロキシLCBはトランス型が多いが,トリヒドロキシLCBはシス型が多いもの(アカザ科,アブラナ科,キク科)もある.マメ科については,シス型トリヒドロキシLCBが多いが,ジヒドロキシLCBについてはバラつきがある.このように,8-不飽和LCBのシス型とトランス型の割合は,概して,植物の科によって特徴的な分布を示す.
4. LC-MS/MSによる植物スフィンゴ脂質の分析
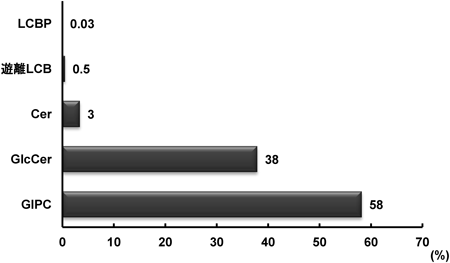
図7はシロイヌナズナの緑葉におけるスフィンゴ脂質の存在割合を示している.GIPC, GlcCerおよびCerを合計すると全体の99%を占めるが,遊離LCBやLCBPも検出される.現在では,高速液体クロマトグラフィー(HPLC)と多重反応モニタリング(MRM)による質量分析を併用することによって,各植物スフィンゴ脂質クラスの分子種の含量と組成を網羅的に概観することができる.筆者らの研究室でも,このような分析手法を導入して,数百ミリグラムの新鮮な葉から,LCBPを除く各スフィンゴ脂質クラスの分子種について,精製の操作をすることなしに分析している.本節では,まずLC-MS/MS分析に求められる植物スフィンゴ脂質の抽出法について概説した後,LC-MS/MSによる植物スフィンゴ脂質分析のポイントとその課題について述べるとともに,最近の分析結果についても紹介する.
1)植物スフィンゴ脂質の抽出溶媒
LC-MS/MS分析が汎用される前までは,緑葉からスフィンゴ脂質を抽出する溶媒として,クロロホルム/メタノール/水の混合溶媒がよく使用された43).この下層を全脂質画分とし,弱アルカリ処理によって,グリセロ脂質を取り除いた後,ケイ酸を固定相とするクロマトグラフィーによって,スフィンゴ脂質クラスを精製し,構成成分を分析する.一方,GIPCはクロロホルム/メタノール/水の混合溶媒で十分に抽出されず,また,可溶化されたものでも上層または中間層にくる.植物のGIPCは,およそ60年前にCarterらによって「フィトグリコリピッド」として初めて報告されたが46),現在でも標準的なGIPCの抽出法が確立されたとはいえず,この脂質クラスに関する知見はそれほど多くない47–49).Markhamらは,GIPCを含む植物スフィンゴ脂質を網羅的に分析するために,シロイヌナズナ,トマト,ダイズの葉の凍結乾燥試料を用いて,抽出溶媒の標準化を検討した50).彼らは,酵母イノシトールホスホセラミド(IPC)の抽出溶媒として知られるエタノール/水/ジエチルエーテル/ピリジン/アンモニア(15/15/5/1/0.018, v/v)51)や,高度病原性真菌の一つパラコクシジオイデス(Paracoccidioides brasiliensis)由来の糖脂質を抽出するイソプロパノール/ヘキサン/水(55/20/25, v/v)の混合溶媒52)が,GIPCを含む植物スフィンゴ脂質を可溶化することを報告した.特に後者の混合溶媒(イソプロパノール/ヘキサン/水)は,イソプロパノールによる試料中のリパーゼ活性を低減する効果もあるとされ,最近は筆者らの研究室もこの溶媒系を基本的に採用している.逆相カラムを使ったLC-MS/MS装置に試料を注入する際は,イソプロパノール/ヘキサン/水の混合溶媒で抽出して得た乾燥試料を0.1%ギ酸を含むTHF/メタノール/水(2/1/2, v/v)に溶解して試料とするが,GIPCの分析については,細胞壁由来と思われる多糖の分解物がGIPCと結びつくようで,予想される分子量に相当するプレカーサーイオンのシグナル強度が実際よりもかなり低く検出される場合がある.そのため,GIPCの回収率が低くなるものの,LC-MS/MS分析の前にケイ酸を固定相とする順相クロマトグラフィー49, 50)によってGIPC画分を精製するか,もしくは,0.1 M塩酸を含むブタノール/水(1/1, v/v)混合溶媒でGIPCを抽出する前処理が必要となる53).なお,THF/メタノール/水(2/1/2, v/v)で分析試料を溶解・保存する際,THFが少ないとノルマル脂肪酸を持つセラミドが可溶化されなかったり析出したりする場合がある.それから,イソプロパノール/ヘキサン/水の混合溶媒は,LCBPの抽出には適さず,0.1%ギ酸を含むメタノール/水(1/1, v/v)54)の方がよく抽出できる.
2)植物スフィンゴ脂質クラスのLC-MS/MS分析
i)セラミド(Cer)とグリコシルイノシトールホスホセラミド(GIPC)の分析
CerとGIPCの構成LCBは,飽和型の分子種が多く,GlcCerの場合と異なり8-不飽和(シスまたはトランス)型のLCBが少ない.そのため,基本的には,MarkhamとJaworskiの方法11)に従って,LCBのシス–トランス異性体を十分に分離しないで分析しているのが現状である.特にCerについては,LCBの8位のシス–トランス異性体を分離する分析条件が定まっておらず,従来の逆相クロマトグラフィーや,それ以外の分離手法も含めて,今後の検討が必要である.また,GIPCにおける糖鎖間のα型またはβ型結合についても,ほとんど解析が進んでおらず,今後の課題である.
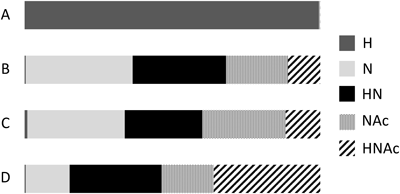
図8はシロイヌナズナといくつかのイネ科植物におけるGIPCの糖組成を示している.シロイヌナズナGIPCのほとんどは,グルクロン酸-イノシトールリン酸-セラミドからなるコア構造(GlcA-Ins-P-Cer)にモノヘキソース(マンノース)がついたものである(図3).最近,シロイヌナズナGIPCの合成に関係すると思われるマンノース輸送体が報告された55).一方,イネ科植物のGIPCでは,モノヘキソースの割合は低く,コア構造にグルコサミンやアセチルグルコサミンが結合している.
ii)グルコシルセラミド(GlcCer)の分析
すでに述べたように,植物GlcCerの特徴の一つは,8-不飽和(シスまたはトランス)型のLCB(図2)が主要な構成成分として見つかることである.植物GlcCerのLC-MS/MS分析に際し,同じアシル鎖を持つがLCB部分のC-8位二重結合のシス–トランス異性だけが異なるGlcCer分子種は分子量が同じなので,MS/MS分析の前にシス–トランス異性体をそれぞれ分離させる必要がある.筆者らの研究室では,GlcCer分子種のベースライン分離のために,炭素含量の高いODSカラム(SUPERIOREX ODS,炭素含量24%,粒子径5 mm, 2.0 mm I.D.×250 mm,資生堂)を直列に2本つなぎ,0.1%ギ酸を含むメタノール/水を移動相溶媒として使用している56, 57).また,MRM測定によるGlcCer分子種のプロダクトイオンの検出は,LCB部分で行っている.一方,この方法の問題点は,1検体あたりの分析時間が,およそ2時間と長いことである.アセトニトリルは,メタノールと比較して高価であるが,メタノール/水よりもアセトニトリル/水の方が送液圧力を低減でき,溶出力が強いことから,逆相HPLCの移動相溶媒としてよく使用される.しかし,植物GlcCerの分子種分析では,シス–トランス異性体の分離があまりよくない.
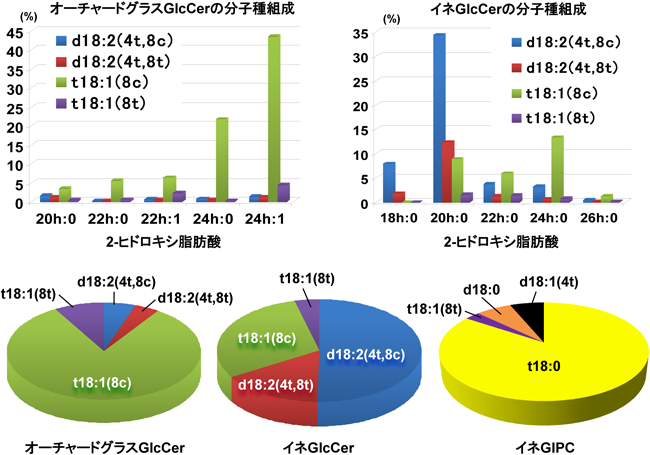
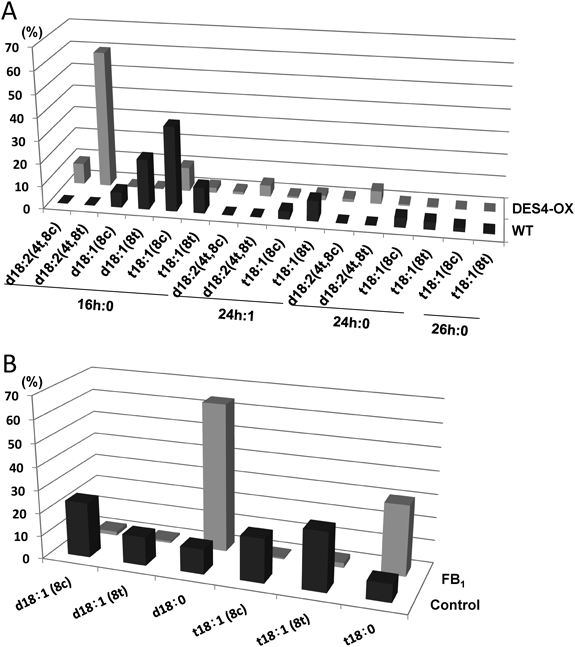
図9はイネ科のオーチャードグラスとイネから抽出した脂質試料を使って,GlcCerを精製せずに,LC-MS/MSによってその分子種組成を解析したものである.オーチャードグラスでは,t18:1(8c)と24h:1を持つ分子種が主要成分であった.また,イネのGlcCerについては,d18:2(4t,8c)と22h:0からなる分子種が主要成分であった.図9の円グラフで示すように,LC-MS/MS分析からLCBの組成を比較すると,オーチャードグラスではt18:1(8c)が非常に多く,イネではd18:2(4t,8c)が約半分を占めることがわかる.またイネのGlcCerとGIPCのLCBの組成を比較すると,興味深いことに,GIPCのLCBはt18:0が非常に多いだけではなく,シス型のLCBがほとんど検出されない.また,図10Aは,シロイヌナズナの緑葉におけるGlcCerの分子種組成を示している.シロイヌナズナのd18:1(4t)の合成に関わる長鎖塩基Δ4不飽和化酵素の遺伝子(DES4)は,花で弱く発現しているが,葉では発現しておらず,したがって,葉のGlcCerに4-不飽和を持ったLCBは検出されない.そこで筆者らは,シロイヌナズナのDES4をCaMV35Sプロモーター(植物器官に非特異的で恒常的に発現する)制御下で発現させた過剰発現株を作製し,緑葉でのGlcCerの分子種組成を野生株と比較した.その結果,スフィンゴシンを持つGlcCer分子種は検出されず,4,8-スフィンガジエニンを持つGlcCer分子種が主成分として見つかった.したがって,DES4はd18:0を持つCer分子種の運命を左右することが示唆された.
iii)遊離長鎖塩基(LCB)と長鎖塩基1-リン酸(LCBP)の分析
LC-MS/MS分析によって遊離LCBを定量する際,LCBの8位のシス–トランス異性体を分離する必要がなければ,4-1)項で述べた植物スフィンゴ脂質の抽出溶媒からの試料を直接分析することで,問題なく遊離LCBのデータを得ることができる.一方,LCBの8位のシス–トランス異性体を分離する場合は,LCBのアミノ基を修飾して分析する方がよい結果が得られている.筆者らはLCBのアミノ基を4-フルオロ-7-ニトロ-2,1,3-ベンゾキサジアゾール(NBD-F)というアミノ酸分析58)に使用される蛍光試薬を使用する方法を検討した59).従来から,LCBのアミノ基をオルトフタルアルデヒドによって蛍光ラベルし蛍光分光検出器によって分析する方法が知られているが60),この方法は非常に高感度であるものの,フタルアルデヒド誘導体は分解が速いという欠点を持っている.一方,NBD誘導体は保存安定性もよく,筆者らの研究室では,NBD誘導体をLC-MS/MS分析または蛍光分光検出の試料として採用している.図10Bは,シロイヌナズナの葉における遊離LCBの分子種組成を示している.d18:0やt18:0といった飽和型LCBの他に,8-不飽和型のLCBが検出される.一方,シロイヌナズナの葉をセラミド合成酵素阻害剤のフモニシンB1(FB1)で数日処理すると,コントロールに比べてd18:0やt18:0の増加(約10倍)がみられるが,8-不飽和型のLCBは増加しない.この結果から,LCBの8-不飽和化は,Cerの段階で行われることが示唆された.
植物のLCBPをLC-MS/MSで定量する際,LCB部分の8位のシス–トランス異性体を分離するために,筆者らの研究室では,LCBPをアセチル化して分析している61).残念ながら,筆者らのLC-MS/MSのシステムでは,数百ミリグラムの新鮮な葉からLCBPを分析することはできないが,FB1で処理した葉では,LCBPを検出することができる.いずれにしても,遊離LCBやLCBPのような存在量の少ない成分に関する分子種を調べる場合は,抽出段階での分解酵素によるアーティファクトが生成しないように,細心の注意を払う必要がある.
この10年間で,シロイヌナズナの形質転換株を用いたスフィンゴ脂質代謝に関する研究と,LC-MS/MSによるスフィンゴ脂質の網羅的分析法の開発によって,植物におけるスフィンゴ脂質の生理機能の理解が大きく進んだ.一方,LC-MS/MSによる網羅的分析法が報告されているとはいえ,本稿で述べたように,多様な構造を持つ植物スフィンゴ脂質分子を簡便かつ網羅的に分析するためには,まだまだ検討すべき課題が残されている.
シロイヌナズナが植物の典型的なスフィンゴ脂質を持っているモデル植物ではないということが明らかになるにつれ,最近では,シロイヌナズナ以外のモデル実験植物を使用して,スフィンゴ脂質の研究を進めるグループもみられる.たとえば,マイクロトムといわれる小さなトマトを使用した研究が米国の研究室で行われている.今後,筆者ら研究室でも,シロイヌナズナで明らかにできないスフィンゴ脂質代謝について,イネ培養細胞やコムギの応用研究に期待されるイネ科モデル実験植物のミナトカモジグサ(Brachypodium distachyon),さらには,マメ科植物のモデル実験植物であるミヤコグサを使用して解析を進めることも計画している.
謝辞Acknowledgments
本稿で紹介した筆者らの研究は,筆者らの研究室に在籍した多くの学部生や大学院生の成果であります.また,埼玉大学大学院理工学研究科環境科学・社会基盤部門の川合真紀教授,石川寿樹助教,徳島大学薬学部生命医療薬学講座の田中保准教授らのご協力のもとで行われました.この紙面を借りて深謝申し上げます.
引用文献References
1) Nagano, M., Ishikawa, T., Ogawa, Y., Iwabuchi, M., Nakasone, A., Shimamoto, K., Uchimiya, H., & Kawai-Yamada, M. (2014) Planta, 240, 77–89.
2) Ryan, P.R., Liu, Q., Sperling, P., Dong, B., Franke, S., & Delhaize, E. (2007) Plant Physiol., 144, 1968–1977.
3) Ng, C.K., Carr, K., McAinsh, M.R., Powell, B., & Hetherington, A.M. (2001) Nature, 410, 596–599.
4) Coursol, S., Fan, L.M., Le Stunff, H., Spiegel, S., Gilroy, S., & Assmann, S.M. (2003) Nature, 423, 651–654.
5) Coursol, S., Le Stunff, H., Lynch, D.V., Gilroy, S., Assmann, S.M., & Spiegel, S. (2005) Plant Physiol., 137, 724–737.
6) Lynch, D.V., Chen, M., & Cahoon, E.B. (2009) Trends Plant Sci., 14, 463–466.
7) Zäuner, S., Ternes, P., & Warnecke, D. (2010) Adv. Exp. Med. Biol., 688, 249–263.
8) Pata, M.O., Hannun, Y.A., & Ng, C.K. (2010) New Phytol., 185, 611–630.
9) Markham, J.E., Lynch, D.V., Napier, J.A., Dunn, T.M., & Cahoon, E.B. (2013) Curr. Opin. Plant Biol., 16, 350–357.
10) 得字圭彦,大西正男(2011)セラミド―基礎と応用―,pp. 56–62,食品化学新聞社.
11) Markham, J.E. & Jaworski, J.G. (2007) Rapid Commun. Mass Spectrom., 21, 1304–1314.
12) Markham, J.E. (2013) Methods Mol. Biol., 1009, 93–101.
13) Minamioka, H. & Imai, H. (2009) J. Plant Res., 122, 415–419.
14) Sugawara, T., Duan, J., Aida, K., Tsuduki, T., & Hirata, T. (2010) Lipids, 45, 451–455.
15) 菅原達也(2011)セラミド—基礎と応用—,pp. 101–107,食品化学新聞社.
16) Hanada, K. (2003) Biochim. Biophys. Acta, 1632, 16–30.
17) Chen, M., Han, G., Dietrich, C.R., Dunn, T.M., & Cahoon, E.B. (2006) Plant Cell, 18, 3576–3593.
18) Han, G., Gupta, S.D., Gable, K., Niranjanakumari, S., Moitra, P., Eichler, F., Brown, R.H. Jr., Harmon, J.M., & Dunn, T.M. (2009) Proc. Natl. Acad. Sci. USA, 106, 8186–8191.
19) Kimberlin, A.N., Majumder, S., Han, G., Chen, M., Cahoon, R.E., Stone, J.M., Dunn, T.M., & Cahoon, E.B. (2013) Plant Cell, 25, 4627–4639.
20) Harmon, J.M., Bacikova, D., Gable, K., Gupta, S.D., Han, G., Sengupta, N., Somashekarappa, N., & Dunn, T.M. (2013) J. Biol. Chem., 288, 10144–10153.
21) Markham, J.E., Molino, D., Gissot, L., Bellec, Y., Hématy, K., Marion, J., Belcram, K., Palauqui, J.C., Satiat-Jeunemaître, B., & Faure, J.D. (2011) Plant Cell, 23, 2362–2378.
22) Ternes, P., Feussner, K., Werner, S., Lerche, J., Iven, T., Heilmann, I., Riezman, H., & Feussner, I. (2011) New Phytol., 192, 841–854.
23) Chen, M., Markham, J.E., & Cahoon, E.B. (2012) Plant J., 69, 769–781.
24) Nagano, M., Ihara-Ohori, Y., Imai, H., Inada, N., Fujimoto, M., Tsutsumi, N., Uchimiya, H., & Kawai-Yamada, M. (2009) Plant J., 58, 122–134.
25) Nagano, M., Takahara, K., Fujimoto, M., Tsutsumi, N., Uchimiya, H., & Kawai-Yamada, M. (2012) Plant Physiol., 159, 1138–1148.
26) Dunn, T.M., Lynch, D.V., Michaelson, L.V., & Napier, J.A. (2004) Ann. Bot. (Lond.), 93, 483–497.
27) Nagiec, M.M., Nagiec, E.E., Baltisberger, J.A., Wells, G.B., Lester, R.L., & Dickson, R.C. (1997) J. Biol. Chem., 272, 9809–9817.
28) Denny, P.W., Shams-Eldin, H., Price, H.P., Smith, D.F., & Schwarz, R.T. (2006) J. Biol. Chem., 281, 28200–28209.
29) Mina, J.G., Okada, Y., Wansadhipathi-Kannangara, N.K., Pratt, S., Shams-Eldin, H., Schwarz, R.T., Steel, P.G., Fawcett, T., & Denny, P.W. (2010) Plant Mol. Biol., 73, 399–407.
30) Wang, W., Yang, X., Tangchaiburana, S., Ndeh, R., Markham, J.E., Tsegaye, Y., Dunn, T.M., Wang, G.L., Bellizzi, M., Parsons, J.F., Morrissey, D., Bravo, J.E., Lynch, D.V., & Xiao, S. (2008) Plant Cell, 20, 3163–3179.
31) Rennie, E.A., Ebert, B., Miles, G.P., Cahoon, R.E., Christiansen, K.M., Stonebloom, S., Khatab, H., Twell, D., Petzold, C.J., Adams, P.D., Dupree, P., Heazlewood, J.L., Cahoon, E.B., & Scheller, H.V. (2013) Plant Cell, 26, 3314–3325.
32) Nishiura, H. & Imai, H. (2005) Plant Cell Physiol., 46, 375–380.
33) Tsegaye, Y., Richardson, C.G., Bravo, J.E., Mulcahy, B.J., Lynch, D.V., Markham, J.E., Jaworski, J.G., Chen, M., Cahoon, E.B., & Dunn, T.M. (2007) J. Biol. Chem., 282, 28195–28206.
34) Nishikawa, M., Hosokawa, K., Ishiguro, M., Minamioka, H., Tamura, K., Hara-Nishimura, I., Takahashi, Y., Shimazaki, K., & Imai, H. (2008) Plant Cell Physiol., 49, 1758–1763.
35) Nakagawa, N., Kato, M., Takahashi, Y., Shimazaki, K., Tamura, K., Tokuji, Y., Kihara, A., & Imai, H. (2012) J. Plant Res., 125, 439–449.
36) Tanaka, T., Kida, T., Imai, H., Morishige, J., Yamashita, R., Matsuoka, H., Uozumi, S., Satouchi, K., Nagano, M., & Tokumura, A. (2013) FEBS J., 280, 3797–3809.
37) Uemura, M. & Steponkus, P.L. (1994) Plant Physiol., 104, 479–496.
38) Ohnishi, M., Ito, S., & Fujino, Y. (1983) Biochim. Biophys. Acta, 752, 416–422.
39) 大西正男(2009)オレオサイエンス,9, 543–551.
40) Imai, H., Ohnishi, M., Kinoshita, M., Kojima, M., & Ito, S. (1995) Biosci. Biotechnol. Biochem., 59, 1309–1313.
41) Watanabe, M., Miyagi, A., Nagano, M., Kawai-Yamada, M., & Imai, H. (2011) Biosci. Biotechnol. Biochem., 75, 877–881.
42) Watanabe, M. & Imai, H. (2011) Biosci. Biotechnol. Biochem., 75, 1838–1841.
43) Imai, H., Yamamoto, K., Shibahara, A., Miyatani, S., & Nakayama, T. (2000) Lipids, 35, 233–236.
44) Smith, M.A., Dauk, M., Ramadan, H., Yang, H., Seamons, L.E., Haslam, R.P., Beaudoin, F., Ramirez-Erosa, I., & Forseille, L. (2013) Plant Physiol., 161, 81–96.
45) Michaelson, L.V., Zäuner, S., Markham, J.E., Haslam, R.P., Desikan, R., Mugford, S., Albrecht, S., Warnecke, D., Sperling, P., Heinz, E., & Napier, J.A. (2009) Plant Physiol., 149, 487–498.
46) Carter, H.E., Gigg, R.H., Law, J.H., Nakayama, T., & Weber, E. (1958) J. Biol. Chem., 233, 1309–1314.
47) Buré, C., Cacas, J.L., Wang, F., Gaudin, K., Domergue, F., Mongrand, S., & Schmitter, J.M. (2011) Rapid Commun. Mass Spectrom., 25, 3131–3145.
48) Hsieh, T.C., Lester, R.L., & Laine, R.A. (1981) J. Biol. Chem., 256, 7747–7755.
49) Ito, S., Kojima, M., & Fujino, Y. (1985) Agric. Biol. Chem., 49, 1873–1875.
50) Markham, J.E., Li, J., Cahoon, E.B., & Jaworski, J.G. (2006) J. Biol. Chem., 281, 22684–22694.
51) Hanson, B.A. & Lester, R.L. (1980) J. Lipid Res., 21, 309–315.
52) Toledo, M.S., Suzuki, E., Straus, A.H., & Takahashi, H.K. (1995) J. Med. Vet. Mycol., 33, 247–251.
53) Voxeur, A. & Fry, S.C. (2014) Plant J., 79, 139–149.
54) Merrill, A.H., Caligan, T.B., Wang, E., Peters, K., & Ou, J. (2000) Methods Enzymol., 312, 3–9.
55) Mortimer, J.C., Yu, X., Albrecht, S., Sicilia, F., Huichalaf, M., Ampuero, D., Michaelson, L.V., Murphy, A.M., Matsunaga, T., Kurz, S., Stephens, E., Baldwin, T.C., Ishii, T., Napier, J.A., Weber, A.P., Handford, M.G., & Dupree, P. (2013) Plant Cell, 25, 1881–1894.
56) Imai, H., Hattori, H., & Watanabe, M. (2012) Lipids, 47, 1221–1229.
57) Ishikawa, T., Yanagawa, D., Maki, K.Y., & Imai, H. (2014) J. Anal. Bioanal. Tech., S5, 007.
58) Watanabe, Y. & Imai, K. (1981) Anal. Biochem., 116, 471–472.
59) Ishikawa, T., Imai, H., & Maki, K.Y. (2014) Lipids, 49, 295–304.
60) Merrill, A.H. Jr., Wang, E., Mullins, R.E., Jamison, W.C., Nimkar, S., & Liotta, D.C. (1988) Anal. Biochem., 171, 373–381.
61) Berdyshev, E.V., Gorshkova, I.A., Garcia, J.G., Natarajan, V., & Hubbard, W.C. (2005) Anal. Biochem., 339, 129–136.
著者紹介Author Profile
 今井 博之(いまい ひろゆき)
今井 博之(いまい ひろゆき)甲南大学理工学部生物学科植物生化学研究室教授.博士(理学).
略歴1963年北海道に生る.92年総合研究大学院大学生命科学研究科博士課程修了.93年オハイオ州立マイアミ大学博士研究員.95年甲南大学理学部講師,2001年同理工学部講師,05年同助教授,07年同准教授を経て,2013年より現職.
研究テーマと抱負スフィンゴ脂質の生理機能,代謝に関する研究,特に植物に存在するスフィンゴ脂質およびその中間代謝産物をモニターする代謝生化学.これからも,スフィンゴ脂質の植物における生理的意義を明らかにするとともに,食糧や物質生産に目を向けた植物科学の研究を進めていきたいと思っています.
ウェブサイトhttp://www.konan-u.ac.jp/hp/plantbioch/
趣味ジョギング.スポーツ観戦.
 柳川 大樹(やながわ だいき)
柳川 大樹(やながわ だいき)甲南大学大学院自然科学研究科生命機能科学専攻博士後期課程3年.
略歴1988年兵庫県に生る.2011年甲南大学理工学部生物学科卒業.13年同大学院自然科学研究科生物学専攻修了.同年甲南大学大学院自然科学研究科生命機能科学専攻入学.
研究テーマと抱負植物のスフィンゴ脂質代謝に関わる酵素の分子生物学的研究 スフィンゴリピドミクス.
趣味野球,テニス,スポーツ観戦.