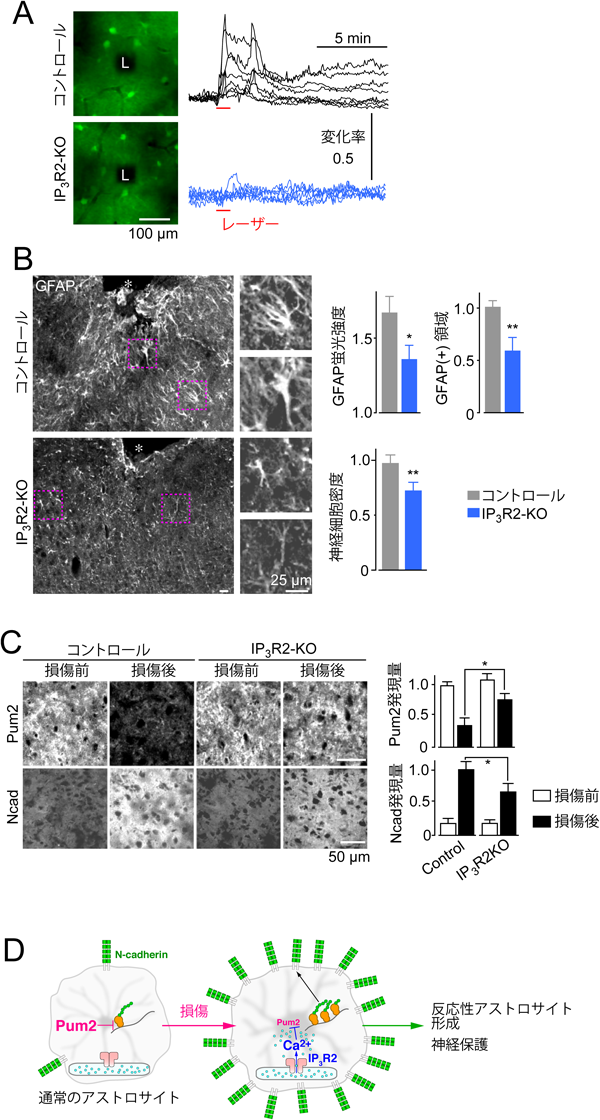
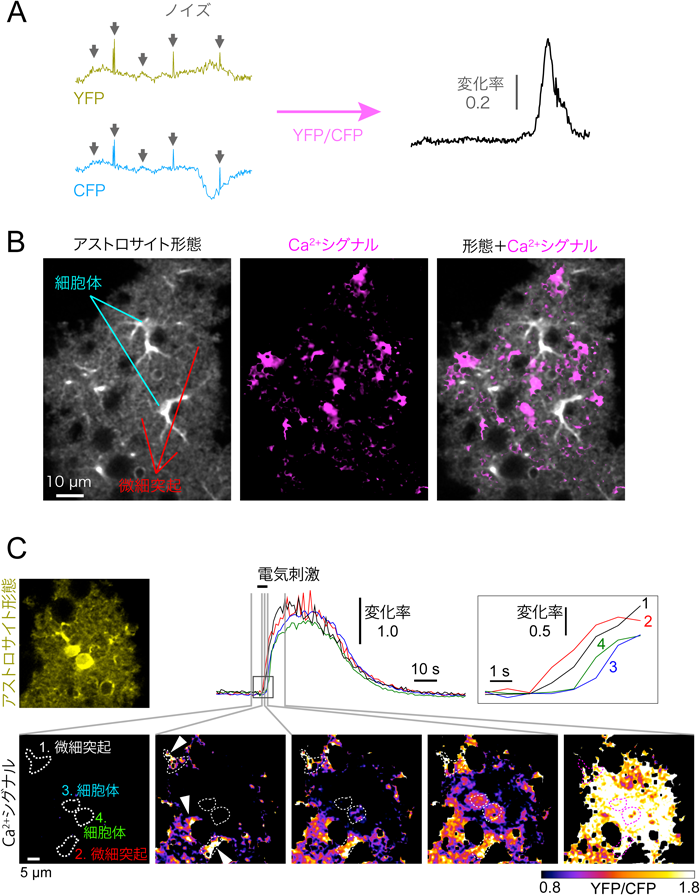
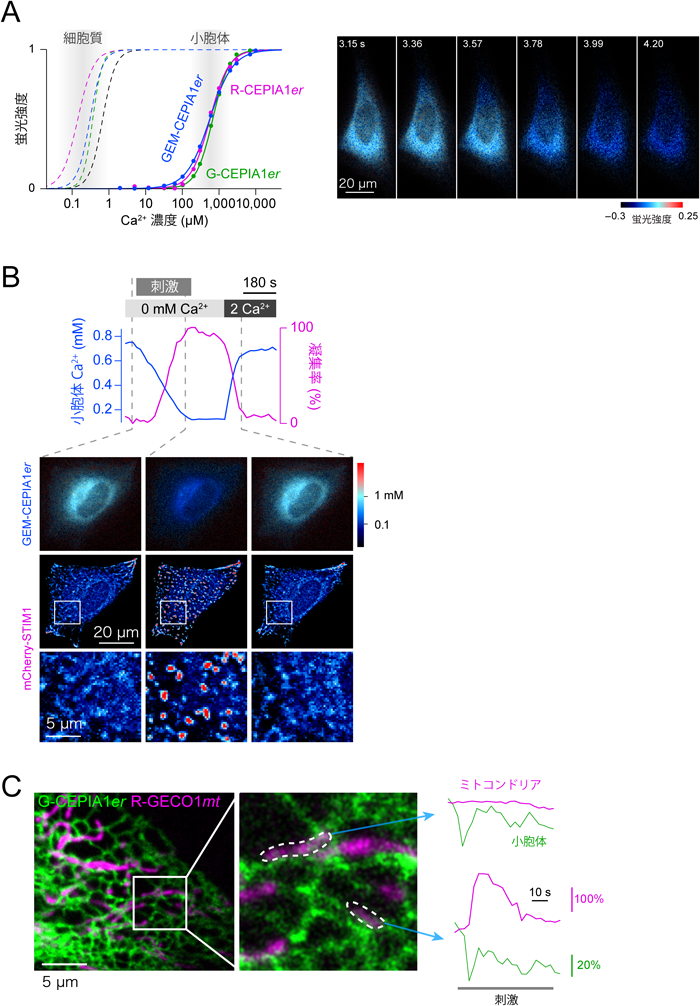
Ca2+シグナルから解明するアストロサイト機能Clarification of astrocytic function through Ca2+ imaging
東京大学大学院医学系研究科細胞分子薬理学教室Department of Pharmacology, Graduate School of Medicine, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1医学部教育研究棟8階 細胞分子薬理学教室 ◇ Hongo 7–3–1, Bunkyo-ku, Tokyo, 113–0033 Japan