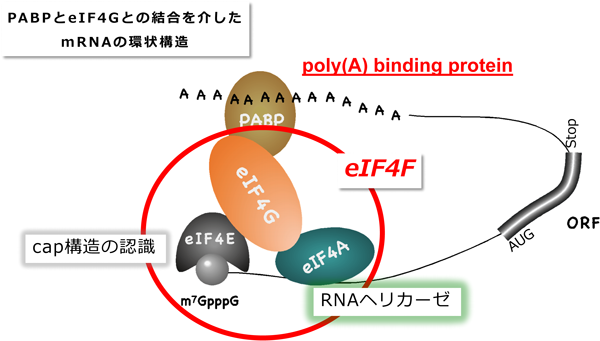
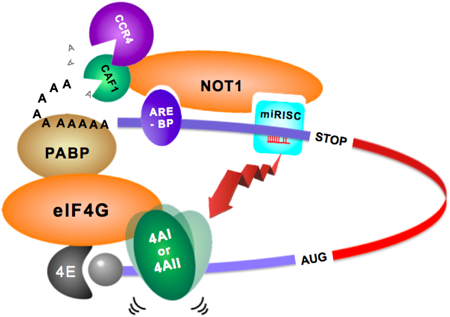
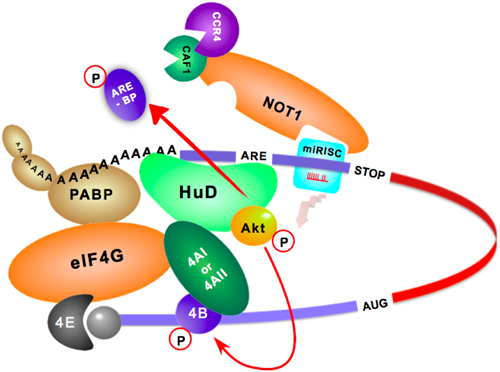
翻訳開始過程を標的としたタンパク質合成のファインチューニングFine-tuning of translation initiation by RNA binding proteins
近畿大学薬学部医療薬学科生化学研究室Laboratory of Biochemistry, Department of Pharmacy, Faculty of Pharmacy, Kinki University ◇ 〒577–8502 大阪府東大阪市小若江3–4–1 ◇ 3–4–1, Kowakae, Higashi-Osaka, Osaka 577–8502, Japan