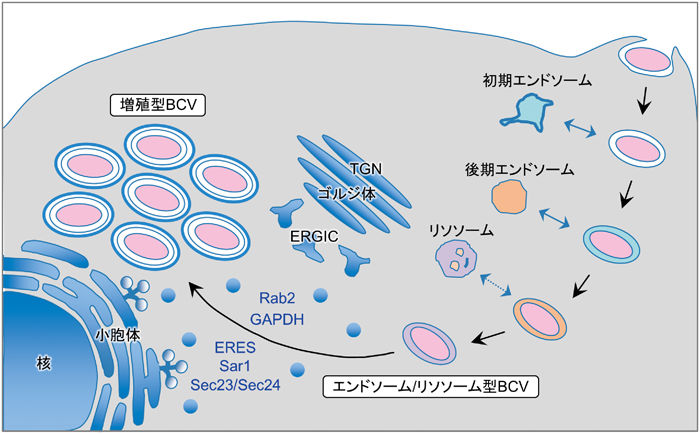
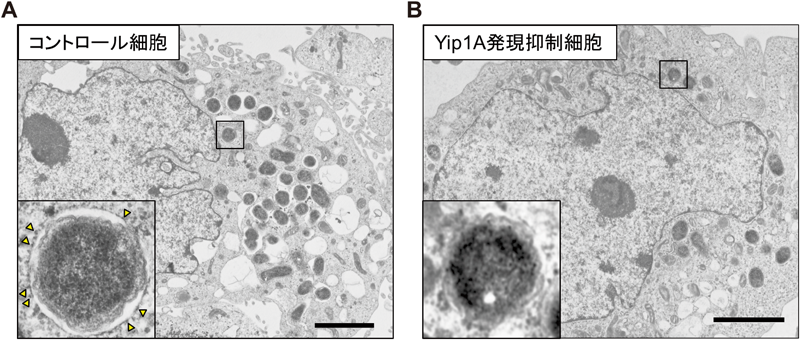
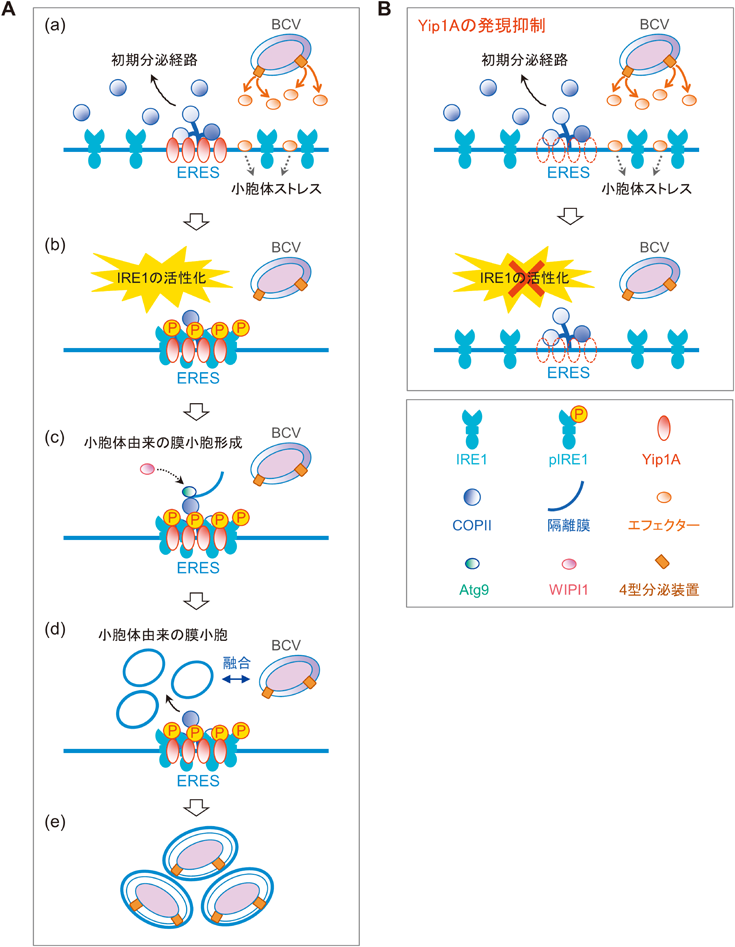
ブルセラ・アボルタス菌の細胞内増殖を制御する新規宿主因子Yip1AYip1A, a novel host factor required for the intracellular replication of Brucella abortus
東京大学大学院総合文化研究科生命環境科学系Department of Life Sciences, Graduate School of Arts and Sciences, The University of Tokyo ◇ 〒153–8902 東京都目黒区駒場3–8–1 ◇ 3–8–1 Komaba, Meguro-ku, Tokyo 153–8902, Japan