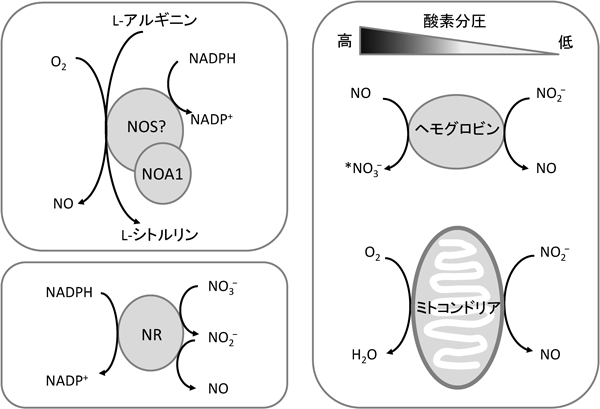
植物の生体防御機構における一酸化窒素の機能Role of Nitric Oxide in Plant Defense System
名古屋大学大学院生命農学研究科生物機構・機能科学専攻Division of Bioresource Functions, Graduate School of Bioagricultural Sciences, Nagoya University ◇ 〒464–8601 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, 464–8601, Japan