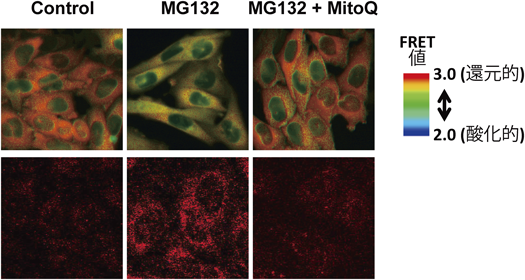
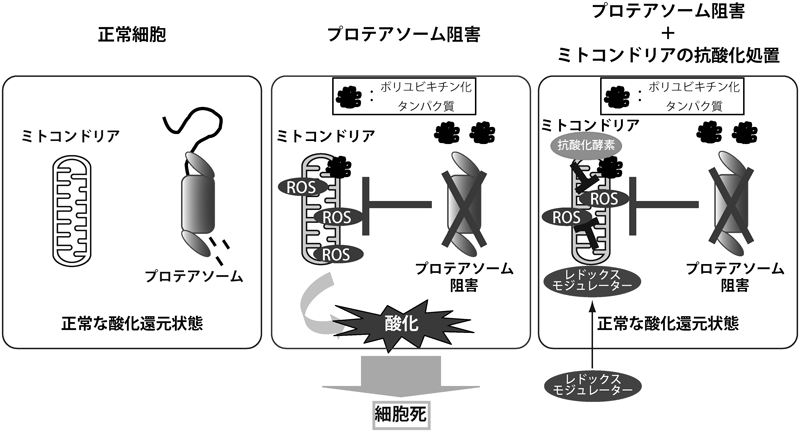
プロテアソーム阻害によるミトコンドリア障害の機構The mechanism of proteasome inhibition-mediated mitochondrial impairment
京都大学学際融合教育研究推進センター生理化学研究ユニットResearch Unit for Physiological Chemistry, the Center for the Promotion of Interdisciplinary Education and Research, Kyoto University ◇ 〒606–8502 京都市左京区北白川追分町 ◇ Kitashirakawa Oiwake-cho, Sakyo-ku, Kyoto 606–8502, Japan