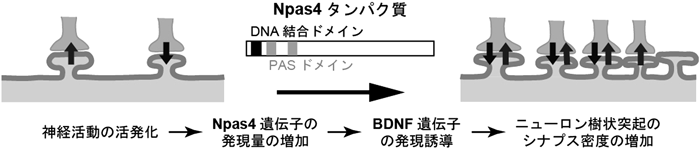
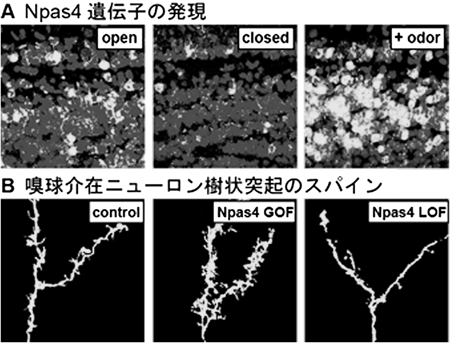
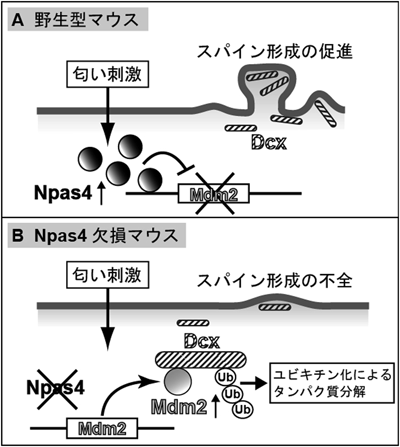
転写因子Npas4による神経活動依存的なシナプス形成の制御機構Transcription factor Npas4 regulates the development of dendritic spines in newborn olfactory bulb interneurons depending on sensory experience
奈良県立医科大学先端医学研究機構脳神経システム医科学Laboratory for Molecular Biology of Neural System, Advanced Medical Research Center, Nara Medical University ◇ 〒634–8521 奈良県橿原市四条町840 ◇ 840 Shijo-cho, Kashihara, Nara 634–8521, Japan