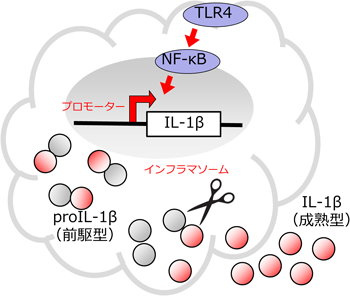
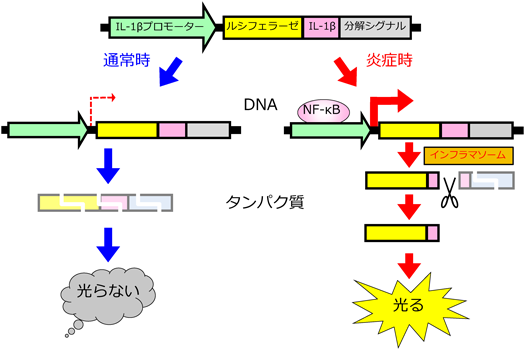
炎症可視化モデルマウスの開発Transgenic mouse model for imaging of inflammation in vivo
群馬大学大学院医学系研究科教育研究支援センターEducation and Research Support Center, Gunma University, Graduate School of Medicine ◇ 〒371–8511 群馬県前橋市昭和町3–39–22 ◇ 3–39–22 Showa-machi, Maebashi, Gunma 371–8511, Japan