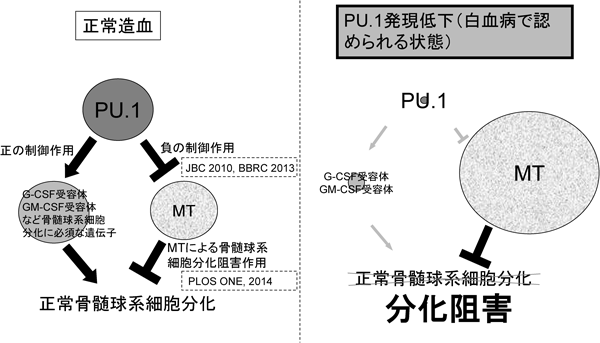
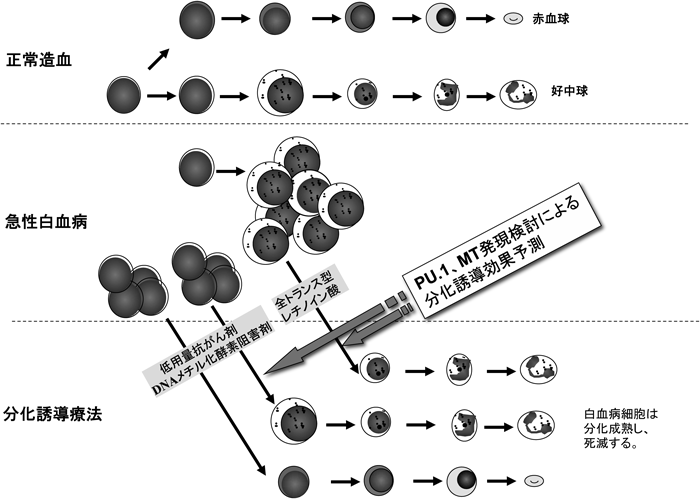
PU.1標的遺伝子の同定による新たな骨髄球系細胞分化機構の解明Clarifying the novel myeloid differentiation mechanisms through identifying PU.1 target genes
北里大学医療衛生学部血液学Kitasato University, School of Allied Health Sciences ◇ 〒252–0373 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitasato, Minamiku, Sagamihara, Kanagawa 252–0373, Japan