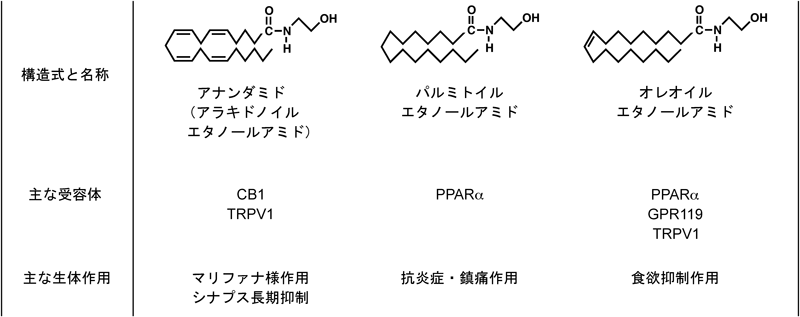
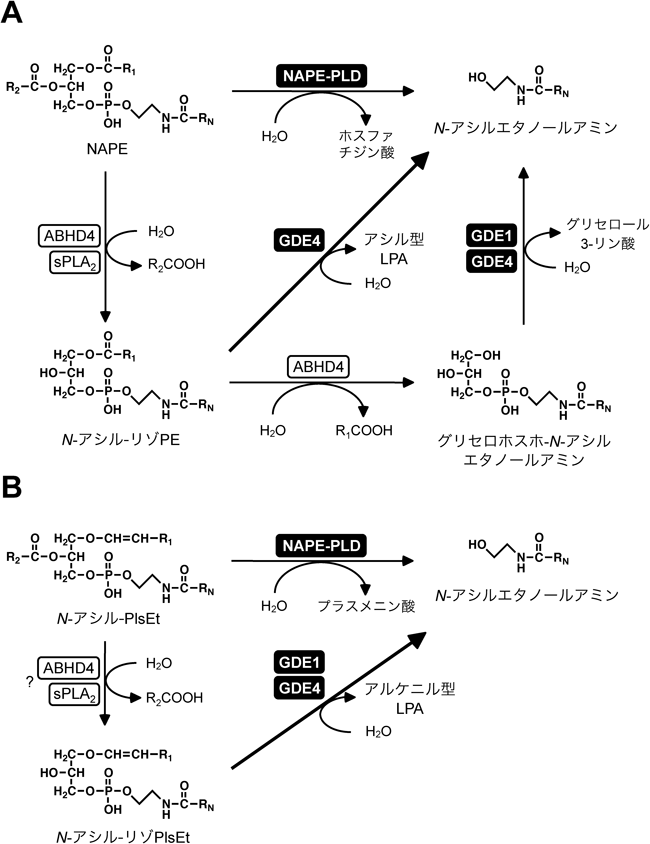
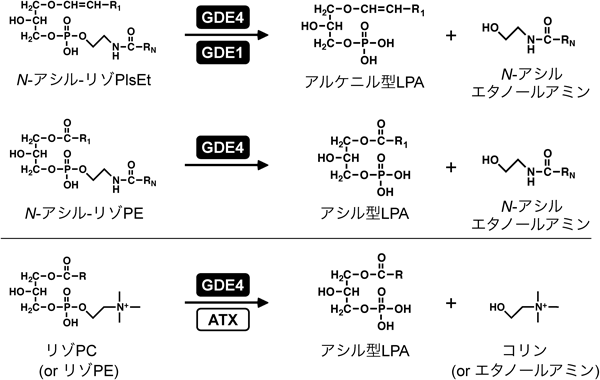
N-アシルエタノールアミンとリゾホスファチジン酸の生合成に関わる新規リゾホスホリパーゼD型酵素Novel lysophospholipase D-type enzymes involved in the biosynthesis of N-acylethanolamines and lysophosphatidic acids
香川大学医学部生体分子医学講座生化学Department of Biochemistry, Kagawa University School of Medicine ◇ 〒761–0793 香川県木田郡三木町池戸1750–1 ◇ 1750–1 Ikenobe, Miki, Kagawa 761–0793, Japan