分泌タンパク質や膜タンパク質を合成する小胞体では,タンパク質の厳密な品質管理が行われており,ここで正しい高次構造を獲得したものだけが,ゴルジ体以降の分泌過程を経てそれぞれの働くべき場所へと輸送される.一方,正しい高次構造をとれなかったタンパク質は,異常タンパク質として細胞質へ逆行輸送され,プロテアソームにより分解される.この機構は小胞体関連分解と呼ばれ,出芽酵母から哺乳類まで広く保存されている1).
小胞体内ではどのように分解すべきタンパク質を選別しているのであろうか? 糖タンパク質の場合,N結合型糖鎖の特定のマンノースが段階的にトリミング(刈り込み)されることで,分解すべき基質として認識されることが明らかとなってきた2).すなわち,このプロセスを担う小胞体局在性マンノシダーゼが分解基質の仕分けに重要な役割を果たすといえる.最近筆者らは,動物培養細胞においてマンノシダーゼ候補分子をノックアウトすることにより,マンノーストリミングを担う分子を特定した3).さらに,構造異常の度合いが高い糖タンパク質は,マンノーストリミングという手順を踏まずに分解されうるという異常糖タンパク質認識の別経路も見いだした4).本稿では,これらの研究内容について紹介する.
小胞体に送り込まれた新生タンパク質の大半は,Asn-X-Ser/Thrモチーフ中のアスパラギン残基に,3個のグルコース,9個のマンノース,2個のN-アセチルグルコサミンからなるGlc3Man9GlcNAc2(G3M9)構造のN結合型糖鎖修飾を受ける(図1A)5).その後,グルコースがトリミングされ,この間に新生タンパク質のフォールディングが進行する(図1B).ここで正しい高次構造を形成した糖タンパク質はゴルジ体へ輸送されるが,フォールディングが完了していない場合はグルコースが再付加されて,再びカルネキシンによるフォールディング介助を受ける(カルネキシンサイクル)5).マンノーストリミングは糖タンパク質が分解経路に入るまでのタイマーの役割を果たすと考えられており,カルネキシンサイクルを繰り返しても正しい高次構造が形成できずにいると,糖鎖の中央の枝(B鎖)からα1,2結合マンノースが切断されたのち(M8B糖鎖へのトリミング),さらにA鎖およびC鎖のα1,2結合マンノースが切断される(M7A, M6あるいはM5糖鎖へのトリミング)2, 5).この2段階のマンノーストリミングにより,C鎖のα1,6結合マンノースが最外部に露出し,この糖鎖構造を認識するOS-9 (osteosarcoma amplified 9)が異常糖タンパク質に結合して小胞体膜上のユビキチンE3リガーゼ複合体へ導く6, 7).その結果,サイトゾルへの逆行輸送とユビキチン化,プロテアソームによる分解が実行されると考えられている.OS-9の糖鎖結合ドメインの構造解析により,C鎖のα1,2結合マンノースはOS-9の結合にとって立体障害となることが示されている8).すなわち,C鎖のα1,2結合マンノースを切断することが,分解におけるマンノーストリミングの意義と捉えることができる.
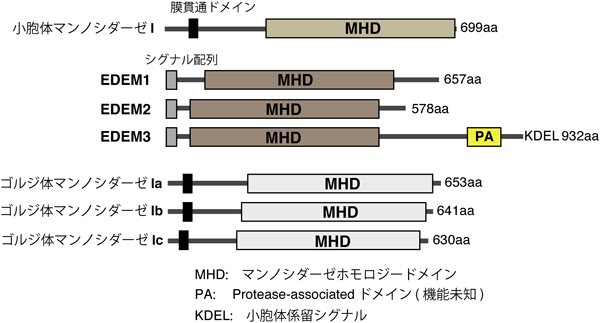
1)小胞体マンノシダーゼIとEDEMファミリータンパク質
α1,2-マンノシダーゼはグリコシダーゼ47ファミリーに分類され,哺乳類にはこのファミリーに属する分子が七つ存在する(図2).このうち,小胞体への局在性が示唆されているのは,小胞体マンノシダーゼI, EDEM1 (ER degradation enhancing α-mannosidase-like protein 1),EDEM2, EDEM3の四つである9).小胞体マンノシダーゼIについては,M9糖鎖をM8B糖鎖へトリミングする活性を持つことがin vitroの解析にて示されている10).また,細胞内に過剰発現させると複数のモデル基質の糖鎖トリミングと分解が促進されることから,マンノーストリミングの第1段階(M9→M8B)を実行する酵素と考えられてきた.ところが最近になって,内在性の小胞体マンノシダーゼIはゴルジ体タンパク質であるという報告がなされ,その細胞内局在について論争が起きている11).
EDEM1, 2, 3はいずれも細胞内に過剰発現させると異常糖タンパク質の分解を促進する.EDEM1およびEDEM3は,過剰発現によりM8B糖鎖を基質とするマンノシダーゼであることが示唆されているが12, 13),リコンビナントタンパク質の調製が難しく,過剰発現以外の実験系による酵素活性の検出はできていない.EDEM2については,細胞内への過剰発現およびin vitro解析の結果から,マンノシダーゼ活性を持たないとされている14).以上のように,さまざまな解析がなされているものの,細胞内でどの分子がどのように機能しているか不明な点も多い.そこで筆者らは,遺伝子ノックアウト解析により,これら候補分子の細胞内機能を検討した.
2)遺伝子ノックアウト解析による酵素活性および基質特異性の同定
近年,人工ヌクレアーゼを用いて任意のDNA配列を切断するゲノム編集技術が確立され,従来は困難であった哺乳類細胞においても遺伝子ノックアウトを行うことが可能になった.筆者らはその改良型の一つであるPlatinum TALEN (transcription activator-like effector nuclease)15)を活用して,EDEM1, 2, 3それぞれを欠損したヒトHCT116細胞(大腸がん由来)を樹立し,糖鎖トリミングに対する影響を解析した3).また,相同組換え効率が高く遺伝子ノックアウトが比較的容易なニワトリDT40細胞(B細胞由来)においては,小胞体マンノシダーゼI, EDEM1, 2, 3すべてについてそれぞれ欠損株を樹立した.
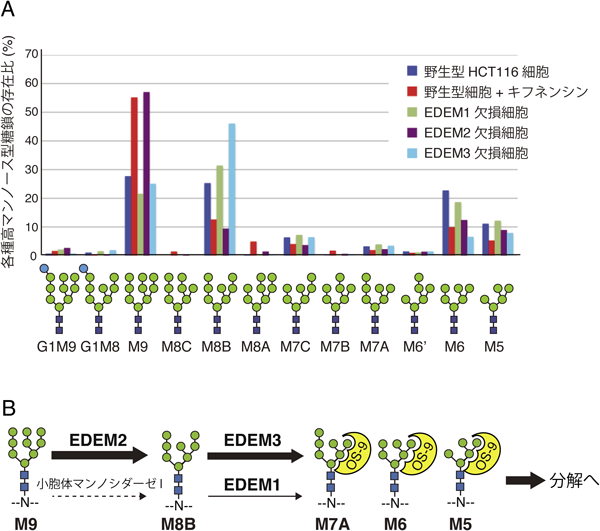
野生型細胞と各ノックアウト細胞からすべての糖タンパク質のN結合型糖鎖を抽出し,高速液体クロマトグラフィーを用いて糖鎖プロファイリングを行った.意外なことに,これまでM9糖鎖のトリミングに関わると考えられてきた小胞体マンノシダーゼIを欠損させても,M9糖鎖を持つタンパク質がわずかに増加したのみであった.驚いたことに,HCT116細胞,DT40細胞いずれにおいても,これまで酵素活性がないとされていたEDEM2を欠損させると,M9糖鎖が野生型細胞に比べてほぼ倍増し,それに相関してM8B糖鎖が減少した(図3A)3).また,EDEM2の欠損によるM9糖鎖の増加量は,広範なα1,2-マンノシダーゼに対する阻害剤キフネンシンの効果と同程度であった.これらのことから,EDEM2がM9糖鎖を基質とするα1,2-マンノシダーゼ活性を持つことが強く示唆されるとともに,M9糖鎖のトリミングは主にEDEM2が担うことが明らかとなった.2種類の細胞において同様の結果が得られたことから,EDEM2の機能は生物種や発現組織に関わらず普遍的なものと考えられた.
また,EDEM3欠損細胞では,M8B糖鎖が特異的に増加し,M6, M5糖鎖が顕著に減少した(図3A).EDEM1欠損細胞においても,M8B糖鎖の増加が認められた.これらのことから,細胞内のEDEM1およびEDEM3はM8B糖鎖を基質とするα1,2-マンノシダーゼとして機能すること,EDEM3の寄与がEDEM1よりも大きいことが明らかとなった.
3)EDEM2は糖タンパク質の分解に必須である
次に,糖タンパク質の分解への影響を調べた.ATF6α (activating transcription factor 6α)は変異を持たない機能性タンパク質でありながら,半減期2時間という短い時間で代謝される不安定な糖タンパク質である.HCT116細胞を用いてATF6αの分解速度を調べたところ,EDEM2欠損細胞ではほぼ分解が停止し,次いでEDEM3欠損細胞,EDEM1欠損細胞の順に分解が遅延した3).この結果は,糖鎖トリミングの抑制効果とよく相関した.EDEM2欠損細胞では,糖鎖トリミングが抑制されたことによるATF6αの分子量シフトも観察された.EDEM2欠損細胞に野生型EDEM2を安定的に導入すると,ATF6αの分子量シフトは解消され,分解も正常に行われた.一方,α1,2-マンノシダーゼ活性に必須と予想される残基を置換したEDEM2 (E117Q)は,その回復能力を失った.したがって,EDEM2はα1,2-マンノシダーゼとしてATF6αの分解を促進していると考えられた.以上の結果から,糖タンパク質の分解において,EDEM2がマンノーストリミングの第1段階を実行し,EDEM3およびEDEM1が第2段階のトリミングを実行する新しいモデルを提唱した(図3B).
4. マンノーストリミングに依存しない糖タンパク質分解
三つのEDEMタンパク質をすべて欠損したHCT116細胞では,ATF6α, EMC1 (ER membrane protein complex subunit 1),膜貫通領域を欠失したCD3-δ変異体(CD3-δ-ΔTM)など,糖鎖を持つ複数のモデル基質の分解が遅延する4).したがって,EDEMタンパク質によるマンノーストリミングは,広範な糖タンパク質の分解に寄与すると考えられる.一方,α1-アンチトリプシンのNHK (null Hong Kong)変異体については,初期の遅延は認められたものの,一定の時間を経過すると正常に分解された.筆者らは,NHK変異体がC末端領域の欠落とアミノ酸挿入変異を持つことに着目し,高次構造が大きく損なわれた糖タンパク質はマンノーストリミングに依存せず分解されるのではないかと考えた.そこで,アミノ酸置換やアミノ酸挿入により,EMC1およびCD3-δ-ΔTMのさまざまな変異体を作製し,EDEM1/2/3トリプルノックアウト細胞における分解効率を検討した.その結果,高次構造に大きな変化がない変異体の分解は遅延したが,構造が大きく損なわれた変異体は一定時間が経過すると正常に分解された.すなわち,構造異常の度合いが高い糖タンパク質をマンノーストリミングに依存せず選別し,それらを強制的に分解する機構が存在することが示唆された.
本稿で紹介したように,EDEMファミリータンパク質がいずれも細胞内でマンノシダーゼとして機能することが示された.特に,これまで見過ごされてきたEDEM2の重要性がクローズアップされたことにより,新しい視点で小胞体内のマンノーストリミング機構を理解することが可能となった.EDEM2に着目した解析を行うことにより,分解すべき糖タンパク質がどのように選別されるかが詳しく明らかになっていくことを期待したい.
出芽酵母では,本稿で紹介したような重度の構造異常糖タンパク質をマンノーストリミング非依存的に強制分解する例は見つかっていない.したがって,細胞にとって有害な構造異常タンパク質を積極的に処分する機構が進化の過程で備えられたのかもしれない.今後はこの強制分解がどのような機構により行われているかについても明らかにしたいと考えている.