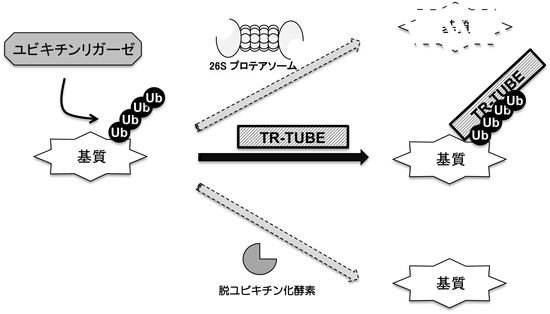
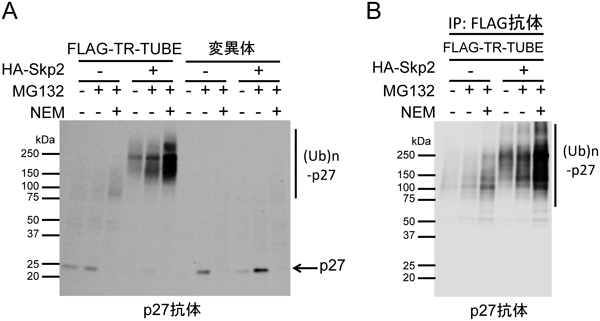
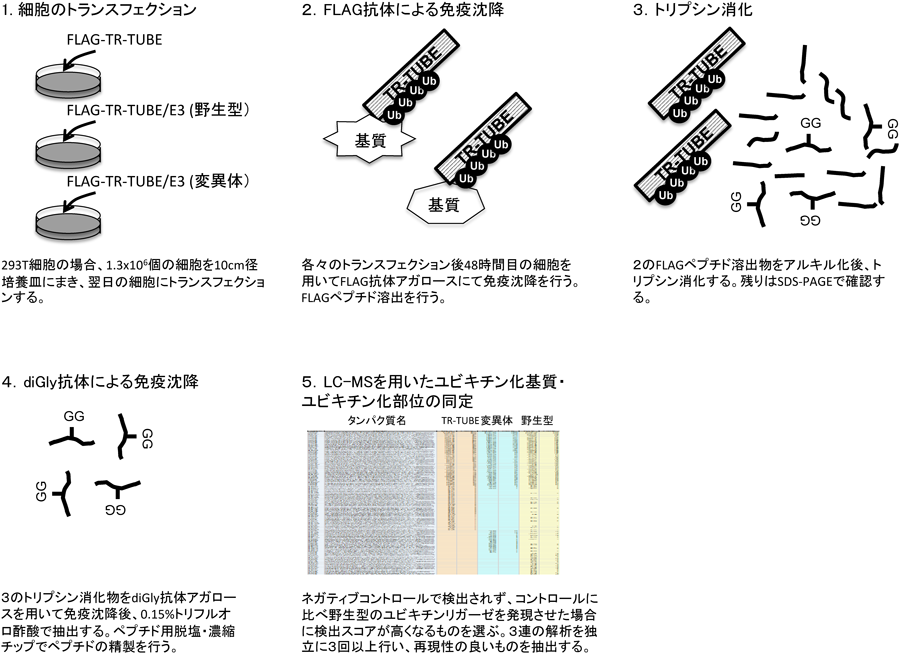
ユビキチンリガーゼの基質の同定法の開発Development of a method for identifying the substrates of specific ubiquitin ligases
(公財)東京都医学総合研究所・ユビキチンプロジェクトUbiquitin Project, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo, 156–8506, Japan