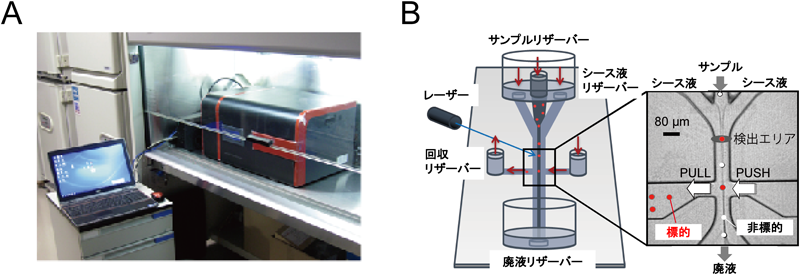
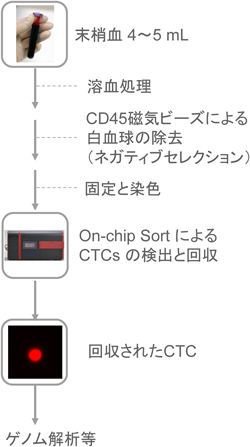
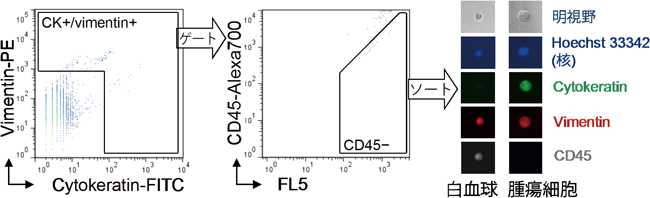
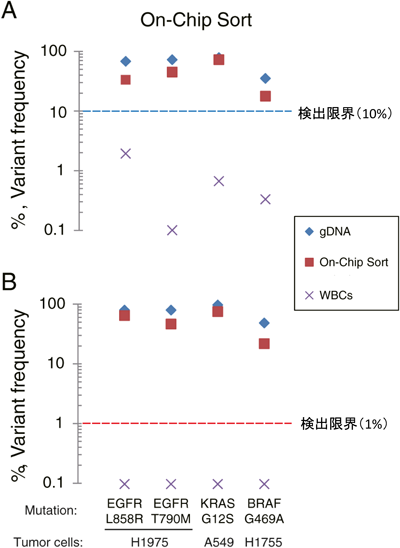
1) Cristofanilli, M., Budd, G.T., Ellis, M.J., Stopeck, A., Matera, J., Miller, M.C., Reuben, J.M., Doyle, G.V., Allard, W.J., Terstappen, L.W., & Hayes, D.F. (2004) N. Engl. J. Med., 351, 781–791.
7) Peeters, D.J., De Laere, B., Van den Eynden, G.G., Van Laere, S.J., Rothé, F., Ignatiadis, M., Sieuwerts, A.M., Lambrechts, D., Rutten, A., van Dam, P.A., Pauwels, P., Peeters, M., Vermeulen, P.B., & Dirix, L.Y. (2013) Br. J. Cancer, 108, 1358–1367.
8) Jiang, R., Lu, Y.T., Ho, H., Li, B., Chen, J.F., Lin, M., Li, F., Wu, K., Wu, H., Lichterman, J., Wan, H., Lu, C.L., OuYang, W., Ni, M., Wang, L., Li, G., Lee, T., Zhang, X., Yang, J., Rettig, M., Chung, L.W., Yang, H., Li, K.C., Hou, Y., Tseng, H.R., Hou, S., Xu, X., Wang, J., & Posadas, E.M. (2015) Oncotarget., 6, 44781–44793.
9) Cann, G.M., Gulzar, Z.G., Cooper, S., Li, R., Luo, S., Tat, M., Stuart, S., Schroth, G., Srinivas, S., Ronaghi, M., Brooks, J.D., & Talasaz, A.H. (2012) PLoS ONE, 7, e49144.
10) Ozkumur, E., Shah, A.M., Ciciliano, J.C., Emmink, B.L., Miyamoto, D.T., Brachtel, E., Yu, M., Chen, P.I., Morgan, B., Trautwein, J., Kimura, A., Sengupta, S., Stott, S.L., Karabacak, N.M., Barber, T.A., Walsh, J.R., Smith, K., Spuhler, P.S., Sullivan, J.P., Lee, R.J., Ting, D.T., Luo, X., Shaw, A.T., Bardia, A., Sequist, L.V., Louis, D.N., Maheswaran, S., Kapur, R., Haber, D.A., & Toner, M. (2013) Sci. Transl. Med., 5, 179ra47.
11) Buim, M.E., Fanelli, M.F., Souza, V.S., Romero, J., Abdallah, E.A., Mello, C.A., Alves, V., Ocea, L.M., Mingues, N.B., Barbosa, P.N., Tyng, C.J., Chojniak, R., & Chinen, L.T. (2015) Cancer Biol. Ther., 16, 1289–1295.
12) Pailler, E., Auger, N., Lindsay, C.R., Vielh, P., Islas-Morris-Hernandez, A., Borget, I., Ngo-Camus, M., Planchard, D., Soria, J.C., Besse, B., & Farace, F. (2015) Ann. Oncol., 26, 1408–1415.
13) Watanabe, M., Uehara, Y., Yamashita, N., Fujimura, Y., Nishio, K., Sawada, T., Takeda, K., Koizumi, F., & Koh, Y. (2014) Cytometry A, 85, 206–213.
14) Watanabe, M., Serizawa, M., Sawada, T., Takeda, K., Takahashi, T., Yamamoto, N., Koizumi, F., & Koh, Y. (2014) J. Transl. Med., 12, 143.
16) Watanabe, M., Kenmotsu, H., Serizawa, M., Abe, M., Ko, R., Imai, H., Taira, T., Naito, T., Murakami, H., Endo, M., Nakajima, T., Takahashi, T., & Koh, Y. (2014) 日本癌学会学術集会,P-2377.
17) Hodgkinson, C.L., Morrow, C.J., Li, Y., Metcalf, R.L., Rothwell, D.G., Trapani, F., Polanski, R., Burt, D.J., Simpson, K.L., Morris, K., Pepper, S.D., Nonaka, D., Greystoke, A., Kelly, P., Bola, B., Krebs, M.G., Antonello, J., Ayub, M., Faulkner, S., Priest, L., Carter, L., Tate, C., Miller, C.J., Blackhall, F., Brady, G., & Dive, C. (2014) Nat. Med., 20, 897–903.