1) Parsons, D., Jones, S., Zhang, X., Lin, J., Leary, R., Angenendt, P., Mankoo, P., Carter, H., Siu, I.M., Gallia, G.L., Olivi, A., McLendon, R., Rasheed, B.A., Keir, S., Nikolskaya, T., Nikolsky, Y., Busam, D.A., Tekleab, H., Diaz, L.A. Jr., Hartigan, J., Smith, D.R., Strausberg, R.L., Marie, S.K., Shinjo, S.M., Yan, H., Riggins, G.J., Bigner, D.D., Karchin, R., Papadopoulos, N., Parmigiani, G., Vogelstein, B., Velculescu, V.E., & Kinzler, K.W. (2008) Science, 321, 1807–1812.
2) Mardis, E.R., Ding, L., Dooling, D.J., Larson, D.E., McLellan, M.D., Chen, K., Koboldt, D.C., Fulton, R.S., Delehaunty, K.D., McGrath, S.D., Fulton, L.A., Locke, D.P., Magrini, V.J., Abbott, R.M., Vickery, T.L., Reed, J.S., Robinson, J.S., Wylie, T., Smith, S.M., Carmichael, L., Eldred, J.M., Harris, C.C., Walker, J., Peck, J.B., Du, F., Dukes, A.F., Sanderson, G.E., Brummett, A.M., Clark, E., McMichael, J.F., Meyer, R.J., Schindler, J.K., Pohl, C.S., Wallis, J.W., Shi, X., Lin, L., Schmidt, H., Tang, Y., Haipek, C., Wiechert, M.E., Ivy, J.V., Kalicki, J., Elliott, G., Ries, R.E., Payton, J.E., Westervelt, P., Tomasson, M.H., Watson, M.A., Baty, J., Heath, S., Shannon, W.D., Nagarajan, R., Link, D.C., Walter, M.J., Graubert, T.A., DiPersio, J.F., Wilson, R.K., & Ley, T.J. (2009) N. Engl. J. Med., 361, 1058–1066.
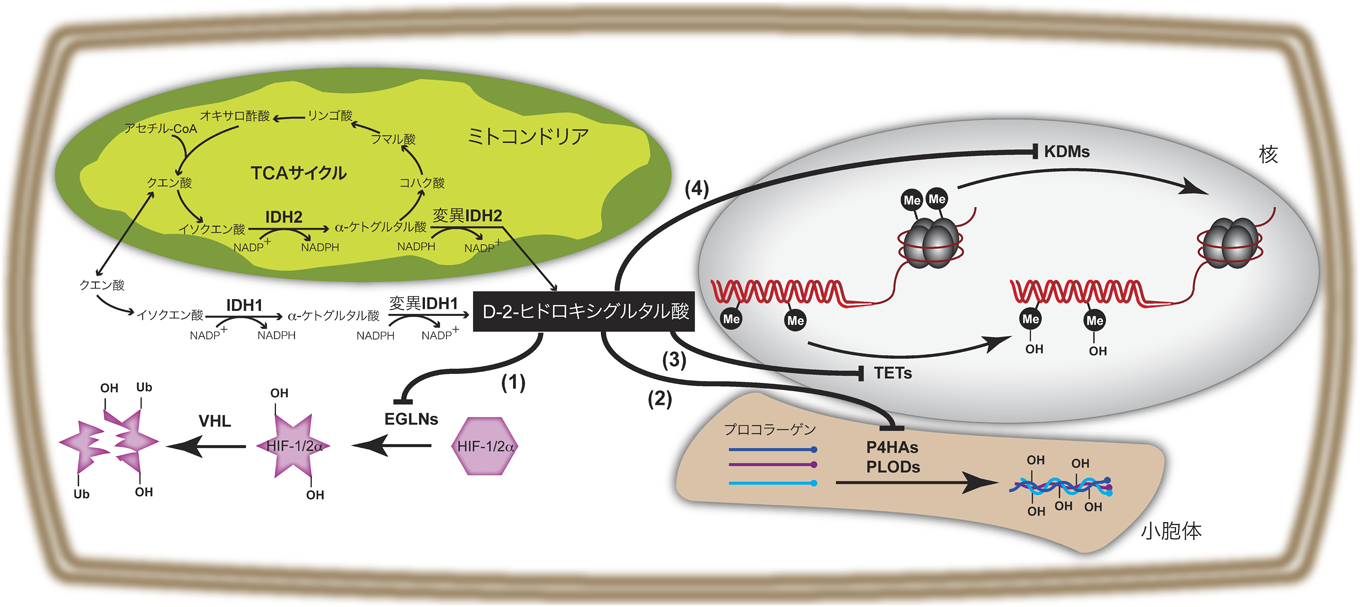
4) Ward, P.S., Patel, J., Wise, D.R., Abdel-Wahab, O., Bennett, B.D., Coller, H.A., Cross, J.R., Fantin, V.R., Hedvat, C.V., Perl, A.E., Rabinowitz, J.D., Carroll, M., Su, S.M., Sharp, K.A., Levine, R.L., & Thompson, C.B. (2010) Cancer Cell, 17, 225–234.
5) Dang, L., White, D.W., Gross, S., Bennett, B.D., Bittinger, M.A., Driggers, E.M., Fantin, V.R., Jang, H.G., Jin, S., Keenan, M.C., Marks, K.M., Prins, R.M., Ward, P.S., Yen, K.E., Liau, L.M., Rabinowitz, J.D., Cantley, L.C., Thompson, C.B., Vander Heiden, M.G., & Su, S.M. (2009) Nature, 462, 739–744.
6) Gross, S., Cairns, R.A., Minden, M.D., Driggers, E.M., Bittinger, M.A., Jang, H.G., Sasaki, M., Jin, S., Schenkein, D.P., Su, S.M., Dang, L., Fantin, V.R., & Mak, T.W. (2010) J. Exp. Med., 207, 339–344.
10) Varier, R.A. & Timmers, H.T. (2011) Biochim. Biophys. Acta, 1815, 75–89.
11) Chowdhury, R., Yeoh, K.K., Tian, Y.M., Hillringhaus, L., Bagg, E.A., Rose, N.R., Leung, I.K., Li, X.S., Woon, E.C., Yang, M., McDonough, M.A., King, O.N., Clifton, I.J., Klose, R.J., Claridge, T.D., Ratcliffe, P.J., Schofield, C.J., & Kawamura, A. (2011) EMBO Rep., 12, 463–469.
12) Xu, W., Yang, H., Liu, Y., Yang, Y., Wang, P., Kim, S.H., Ito, S., Yang, C., Wang, P., Xiao, M.T., Liu, L.X., Jiang, W.Q., Liu, J., Zhang, J.Y., Wang, B., Frye, S., Zhang, Y., Xu, Y.H., Lei, Q.Y., Guan, K.L., Zhao, S.M., & Xiong, Y. (2011) Cancer Cell, 19, 17–30.
13) Koivunen, P., Lee, S., Duncan, C.G., Lopez, G., Lu, G., Ramkissoon, S., Losman, J.A., Joensuu, P., Bergmann, U., Gross, S., Travins, J., Weiss, S., Looper, R., Ligon, K.L., Verhaak, R.G., Yan, H., & Kaelin, W.G. Jr. (2012) Nature, 483, 484–488.
14) Sasaki, M., Knobbe, C.B., Itsumi, M., Elia, A.J., Harris, I.S., Chio, I.I., Cairns, R.A., McCracken, S., Wakeham, A., Haight, J., Ten, A.Y., Snow, B., Ueda, T., Inoue, S., Yamamoto, K., Ko, M., Rao, A., Yen, K.E., Su, S.M., & Mak, T.W. (2012) Genes Dev., 26, 2038–2049.
15) Sasaki, M., Knobbe, C.B., Munger, J.C., Lind, E.F., Brenner, D., Brüstle, A., Harris, I.S., Holmes, R., Wakeham, A., Haight, J., You-Ten, A., Li, W.Y., Schalm, S., Su, S.M., Virtanen, C., Reifenberger, G., Ohashi, P.S., Barber, D.L., Figueroa, M.E., Melnick, A., Zúñiga-Pflücker, J.C., & Mak, T.W. (2012) Nature, 488, 656–659.
16) Hirata, M., Sasaki, M., Cairns, R.A., Inoue, S., Puviindran, V., Li, W.Y., Snow, B.E., Jones, L.D., Wei, Q., Sato, S., Tang, Y.J., Nadesan, P., Rockel, J., Whetstone, H., Poon, R., Weng, A., Gross, S., Straley, K., Gliser, C., Xu, Y., Wunder, J., Mak, T.W., & Alman, B.A. (2015) Proc. Natl. Acad. Sci. USA, 112, 2829–2834.
17) Pfander, D., Kobayashi, T., Knight, M.C., Zelzer, E., Chan, D.A., Olsen, B.R., Giaccia, A.J., Johnson, R.S., Haase, V.H., & Schipani, E. (2004) Development, 131, 2497–2508.
18) Figueroa, M.E., Abdel-Wahab, O., Lu, C., Ward, P.S., Patel, J., Shih, A., Li, Y., Bhagwat, N., Vasanthakumar, A., Fernandez, H.F., Tallman, M.S., Sun, Z., Wolniak, K., Peeters, J.K., Liu, W., Choe, S.E., Fantin, V.R., Paietta, E., Löwenberg, B., Licht, J.D., Godley, L.A., Delwel, R., Valk, P.J., Thompson, C.B., Levine, R.L., & Melnick, A. (2010) Cancer Cell, 18, 553–567.
19) Moran-Crusio, K., Reavie, L., Shih, A., Abdel-Wahab, O., Ndiaye-Lobry, D., Lobry, C., Figueroa, M.E., Vasanthakumar, A., Patel, J., Zhao, X., Perna, F., Pandey, S., Madzo, J., Song, C., Dai, Q., He, C., Ibrahim, S., Beran, M., Zavadil, J., Nimer, S.D., Melnick, A., Godley, L.A., Aifantis, I., & Levine, R.L. (2011) Cancer Cell, 20, 11–24.
20) Quivoron, C., Couronné, L., Della Valle, V., Lopez, C.K., Plo, I., Wagner-Ballon, O., Do Cruzeiro, M., Delhommeau, F., Arnulf, B., Stern, M.H., Godley, L., Opolon, P., Tilly, H., Solary, E., Duffourd, Y., Dessen, P., Merle-Beral, H., Nguyen-Khac, F., Fontenay, M., Vainchenker, W., Bastard, C., Mercher, T., & Bernard, O.A. (2011) Cancer Cell, 20, 25–38.
21) Lu, C., Ward, P.S., Kapoor, G.S., Rohle, D., Turcan, S., Abdel-Wahab, O., Edwards, C.R., Khanin, R., Figueroa, M.E., Melnick, A., Wellen, K.E., O’Rourke, D.M., Berger, S.L., Chan, T.A., Levine, R.L., Mellinghoff, I.K., & Thompson, C.B. (2012) Nature, 483, 474–478.
22) Noushmehr, H., Weisenberger, D.J., Diefes, K., Phillips, H.S., Pujara, K., Berman, B.P., Pan, F., Pelloski, C.E., Sulman, E.P., Bhat, K.P., Verhaak, R.G., Hoadley, K.A., Hayes, D.N., Perou, C.M., Schmidt, H.K., Ding, L., Wilson, R.K., Van Den Berg, D., Shen, H., Bengtsson, H., Neuvial, P., Cope, L.M., Buckley, J., Herman, J.G., Baylin, S.B., Laird, P.W., & Aldape, K.; Cancer Genome Atlas Research Network (2010) Cancer Cell, 17, 510–522.
23) Turcan, S., Rohle, D., Goenka, A., Walsh, L.A., Fang, F., Yilmaz, E., Campos, C., Fabius, A.W., Lu, C., Ward, P.S., Thompson, C.B., Kaufman, A., Guryanova, O., Levine, R., Heguy, A., Viale, A., Morris, L.G., Huse, J.T., Mellinghoff, I.K., & Chan, T.A. (2012) Nature, 483, 479–483.
25) Kats, L.M., Reschke, M., Taulli, R., Pozdnyakova, O., Burgess, K., Bhargava, P., Straley, K., Karnik, R., Meissner, A., Small, D., Su, S.M., Yen, K., Zhang, J., & Pandolfi, P.P. (2014) Cell Stem Cell, 14, 329–341.
26) Rohle, D., Popovici-Muller, J., Palaskas, N., Turcan, S., Grommes, C., Campos, C., Tsoi, J., Clark, O., Oldrini, B., Komisopoulou, E., Kunii, K., Pedraza, A., Schalm, S., Silverman, L., Miller, A., Wang, F., Yang, H., Chen, Y., Kernytsky, A., Rosenblum, M.K., Liu, W., Biller, S.A., Su, S.M., Brennan, C.W., Chan, T.A., Graeber, T.G., Yen, K.E., & Mellinghoff, I.K. (2013) Science, 340, 626–630.
27) Wang, F., Travins, J., DeLaBarre, B., Penard-Lacronique, V., Schalm, S., Hansen, E., Straley, K., Kernytsky, A., Liu, W., Gliser, C., Yang, H., Gross, S., Artin, E., Saada, V., Mylonas, E., Quivoron, C., Popovici-Muller, J., Saunders, J.O., Salituro, F.G., Yan, S., Murray, S., Wei, W., Gao, Y., Dang, L., Dorsch, M., Agresta, S., Schenkein, D.P., Biller, S.A., Su, S.M., de Botton, S., & Yen, K.E. (2013) Science, 340, 622–626.