3) Warburg, O. (1956) Science, 124, 269–270.
4) Iyer, N.V., Kotch, L.E., Agani, F., Leung, S.W., Laughner, E., Wenger, R.H., Gassmann, M., Gearhart, J.D., Lawler, A.M., Yu, A.Y., & Semenza, G.L. (1998) Genes Dev., 12, 149–162.
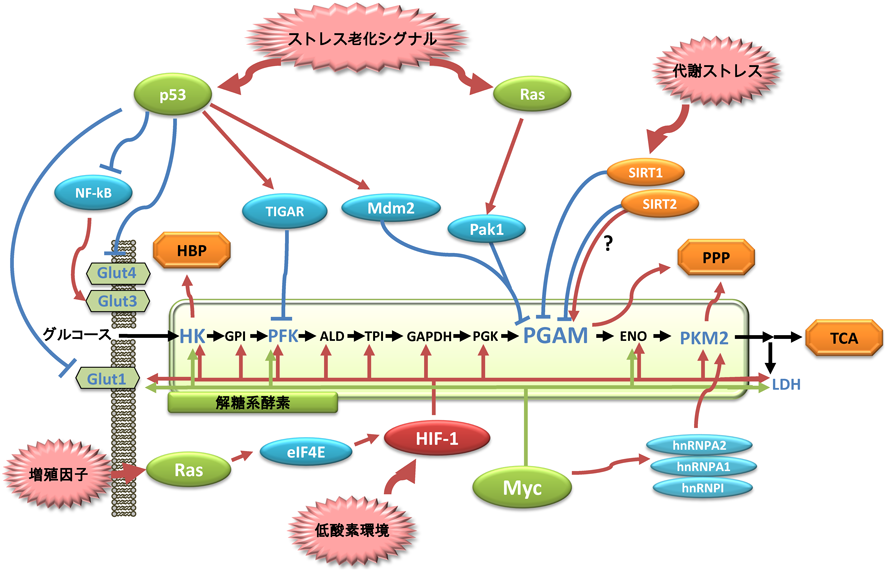
5) Mikawa, T., Lleonart, M.E., Takaori-Kondo, A., Inagaki, N., Yokode, M., & Kondoh, H. (2015) Cell. Mol. Life Sci., 72, 1881–1892.
8) Gitenay, D., Wiel, C., Lallet-Daher, H., Vindrieux, D., Aubert, S., Payen, L., Simonnet, H., & Bernard, D. (2014) Cell Death Dis., 5, e1089.
9) Vander Heiden, M.G., Locasale, J.W., Swanson, K.D., Sharfi, H., Heffron, G.J., Amador-Noguez, D., Christofk, H.R., Wagner, G., Rabinowitz, J.D., Asara, J.M., & Cantley, L.C. (2010) Science, 329, 1492–1499.
11) Li, Z., Yang, P., & Li, Z. (2014) Biochim. Biophys. Acta, 1846, 285–296.
14) Collado, M., Gil, J., Efeyan, A., Guerra, C., Schuhmacher, A.J., Barradas, M., Benguria, A., Zaballos, A., Flores, J.M., Barbacid, M., Beach, D., & Serrano, M. (2005) Nature, 436, 642.
16) Bensaad, K., Tsuruta, A., Selak, M.A., Vidal, M.N., Nakano, K., Bartrons, R., Gottlieb, E., & Vousden, K.H. (2006) Cell, 126, 107–120.
19) Osthus, R.C., Shim, H., Kim, S., Li, Q., Reddy, R., Mukherjee, M., Xu, Y., Wonsey, D., Lee, L.A., & Dang, C.V. (2000) J. Biol. Chem., 275, 21797–21800.
20) Kondoh, H., Lleonart, M.E., Gil, J., Wang, J., Degan, P., Peters, G., Martinez, D., Carnero, A., & Beach, D. (2005) Cancer Res., 65, 177–185.
22) Hitosugi, T., Zhou, L., Elf, S., Fan, J., Kang, H.B., Seo, J.H., Shan, C., Dai, Q., Zhang, L., Xie, J., Gu, T.L., Jin, P., Alečković, M., LeRoy, G., Kang, Y., Sudderth, J.A., DeBerardinis, R.J., Luan, C.H., Chen, G.Z., Muller, S., Shin, D.M., Owonikoko, T.K., Lonial, S., Arellano, M.L., Khoury, H.J., Khuri, F.R., Lee, B.H., Ye, K., Boggon, T.J., Kang, S., He, C., & Chen, J. (2012) Cancer Cell, 22, 585–600.
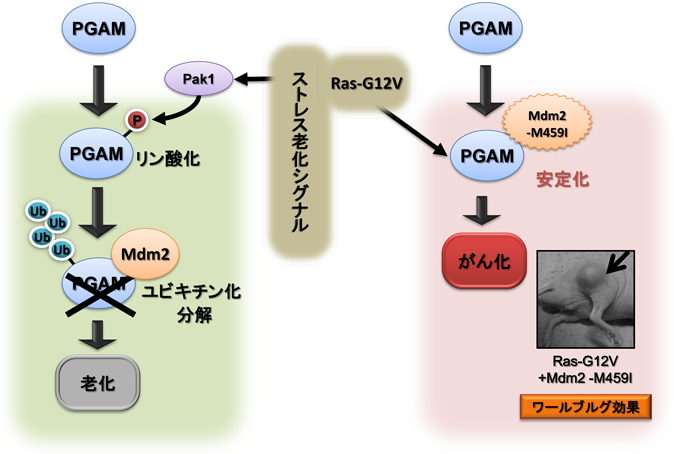
23) Mikawa, T., Maruyama, T., Okamoto, K., Nakagama, H., Lleonart, M.E., Tsusaka, T., Hori, K., Murakami, I., Izumi, T., Takaori-Kondo, A., Yokode, M., Peters, G., Beach, D., & Kondoh, H. (2014) J. Cell Biol., 204, 729–745.
24) Cooper, J.A. & Hunter, T. (1983) J. Biol. Chem., 258, 1108–1115.
25) Hitosugi, T., Zhou, L., Fan, J., Elf, S., Zhang, L., Xie, J., Wang, Y., Gu, T.L., Aleckovic, M., LeRoy, G., Kang, Y., Kang, H.B., Seo, J.H., Shan, C., Jin, P., Gong, W., Lonial, S., Arellano, M.L., Khoury, H.J., Chen, G.Z., Shin, D.M., Khuri, F.R., Boggon, T.J., Kang, S., He, C., & Chen, J. (2013) Nat. Commun., 4, 1790.
29) Tsusaka, T., Guo, T., Yagura, T., Inoue, T., Yokode, M., Inagaki, N., & Kondoh, H. (2014) Genes Cells, 19, 766–777.
30) Xu, Y., Li, F., Lv, L., Li, T., Zhou, X., Deng, C.X., Guan, K.L., Lei, Q.Y., & Xiong, Y. (2014) Cancer Res., 74, 3630–3642.