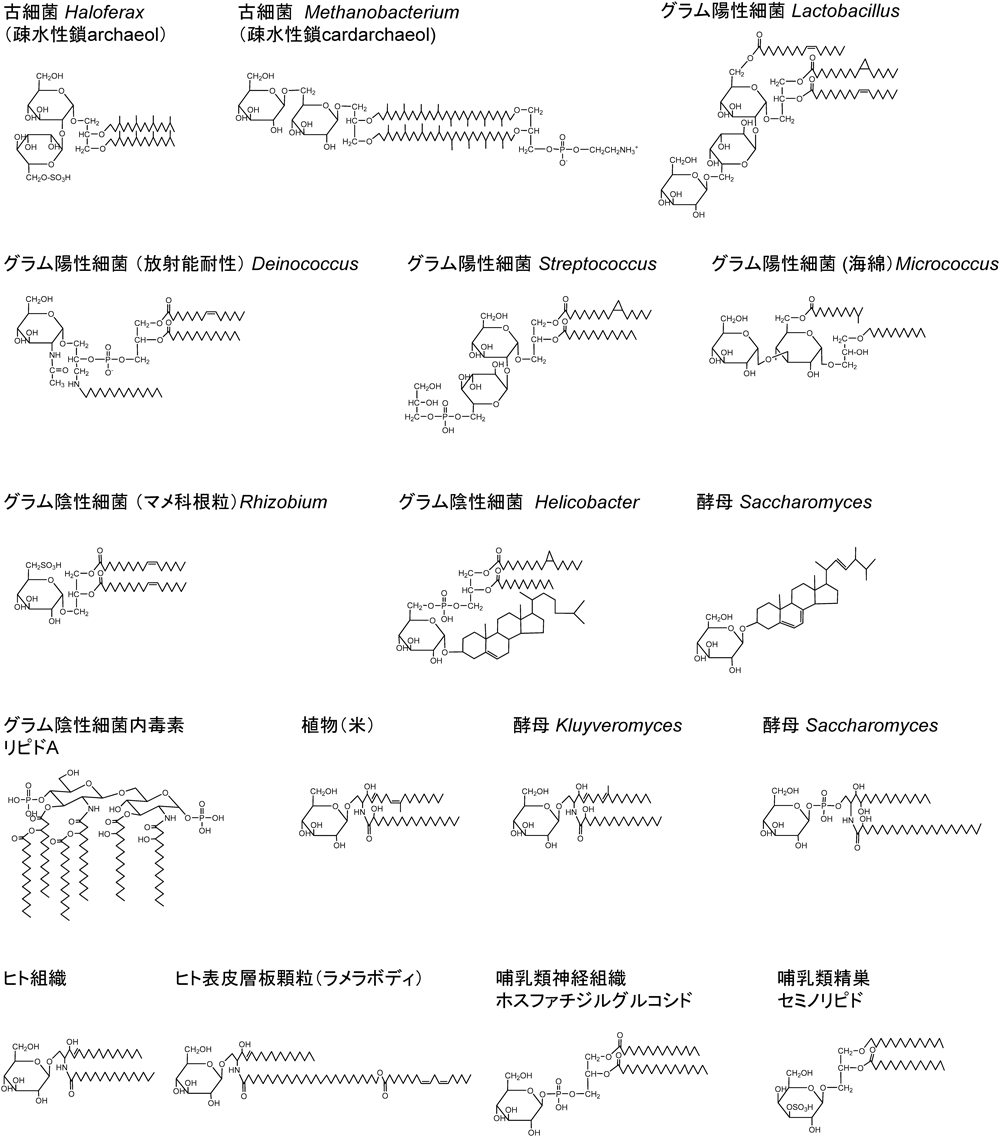
細胞膜は生物の最小単位である細胞の隔壁構造として,生体四大成分,核酸,タンパク質,糖質,脂質を細胞内空間に集積させ,生命活動を支えている.最も単純な細胞構造を持つ赤血球の場合,細胞膜脂質二分子膜の厚みを透過電子顕微鏡で観察すると,約7 nmである.赤血球の長径は7 µmであることから,膜の厚みと長径の比は1 : 1000の関係にあり,仮に,1 mmの厚みの膜で赤血球モデルを作ると1 mの大きさになることから,いかに薄い膜が赤血球を形作っているのかがわかる.さらに,脂質二分子膜の外には50~数100 nmに及ぶ糖衣(glycocalyx)があり,赤血球全体を糖が覆っているようすが観察できる.微生物から真核生物まですべての細胞は糖衣を持っている.生体四大成分の中で糖は最も水酸基の多い構造であり,水分子を結合しやすく,糖衣は細胞周囲に水分子の層を形成し,細胞膜を介した物質の出入りやシグナルの授受など水を媒介にした反応を支えている.糖を細胞膜に固定する役割はタンパク質と脂質が担っており,これらは複合糖質(glycoconjugate)に分類されている.ポリペプチド鎖に糖鎖が結合した複合糖質には基本糖鎖構造の違いにより糖タンパク質とプロテオグリカンがあり,糖脂質は文字どおり疎水性脂質に糖が結合した構造である.ポリペプチド鎖に結合した糖鎖が細胞膜外に広がっているのに対し,脂質に結合した糖鎖は膜上に分布しているという違いがある.脂質二分子膜の基本成分はリン脂質,コレステロール,糖脂質が占めている.これらを混合し,ナスフラスコ壁面に薄膜を作り,緩衝液を加えて超音波処理で作製した多層リポソームにおいては脂質二分子膜内外層に糖脂質の糖鎖が分布しているが,赤血球をはじめとする細胞では外層にもっぱら露出していることが,抗体や毒素プローブを用いた電子顕微鏡観察,および内外層反転赤血球を用いて示されている.
赤血球の糖脂質が血液型抗原になっている発見に加え,山川民夫先生によりウマ赤血球からシアル酸を含む糖脂質GM3の構造が決定されたことが1),糖脂質研究の急拡大を引き起こす契機となった.山川先生の研究室からは各種動物赤血球の種特異的構造と抗赤血球抗血清と反応する糖鎖,脳や精巣に特異的に分布する糖脂質が次々に発表された1).さらに,糖脂質研究を牽引する役割を果たしたのは,糖脂質の蓄積を伴う先天性糖脂質代謝異常症である2).Gaucher病,Krabbe病,Tay-Sachs病などにみられる糖脂質の蓄積による精神的,身体的症状の激しさは特定の組織における糖脂質の役割の重大性を認識させるとともに,疎水性構造を持つ糖脂質の代謝に関わるアクチベータータンパク質やトランスポータータンパク質など,水系での疎水性糖脂質の代謝を支える分子を浮かび上らせることになった3, 4).同じころ,アメリカを拠点として研究を展開しておられた箱守仙一郎先生は完全メチル化により糖鎖の結合位置を解析する簡便法を開発し,この方法を駆使することにより血液型糖脂質の構造をはじめがん化に伴って変化する糖脂質,腫瘍マーカー糖鎖を次々に明らかにした.さらに糖鎖の役割として,糖鎖—糖鎖,および糖鎖受容体とリガンドの反応など,細胞外糖鎖シグナルの位置づけを明確化した5).現在でも糖脂質は腫瘍マーカーとして臨床診断に用いられ,また黒色腫では糖脂質に対する抗体によるミサイル療法も実施され制がん効果が得られている6).一方,細胞の分化に伴って変化する糖脂質分子自体がシグナルとして生理活性を持つとの見方も広まり,骨髄芽球性白血病細胞HL-60にホルボールエステルを添加して培養すると単球マクロファージ系細胞に,レチノイン酸,またはジメチルスルホキシド(DMSO)で培養すると顆粒球系細胞に分化するとの知見を基に,分化後に発現する糖脂質GM3, IV3NeuAcα-nLc4CerをHL-60の培養培地に添加することにより,それぞれ単球系および顆粒系細胞への分化方向を運命づけることが可能であるとの実験的証明が行われた7–9).神経系細胞についても糖脂質の添加により,神経成長因子(NGF)による多方向性の突起伸長とは異なる双方向性の神経突起伸長が引き起こされ,切断された神経の再生効果が期待できるとされた.イタリアのFidia社が販売を開始したクロナシアルはウシ脳ガングリオシドの生理食塩水溶液であり,この製剤によるヒトのアルコール性末梢神経炎,顔面麻痺患者に対する良好な治験結果も報告され始め,わが国でも神経内科医を中心に治験に向けた研究会が立ち上げられた10, 11).しかし,永井克孝先生によりウサギにジシアロガングリオシドGD1aをフロイントの完全アジュバントとともに皮下注射すると,ガングリオシド症候群と名づけられた,下肢の麻痺を伴う実験的アレルギー性神経炎が引き起こされることが示され12),さらに,Campylobacter jejuni, Mycoplasma pneumoniae, Pasteurella multocida, Haemophilus influenza,Epstein–Barrウイルスやサイトメガロウイルス感染後に発症するGuillain Barré症候群,Tolosa–Hunt症候群,Miller–Fisher症候群などの末梢神経炎がガングリオシドに対する抗体によって引き起こされることが明らかになり13–16),追い討ちをかけるように,クロナシアル筋注後の患者血中にガングリオシドに対する抗体が検出されるにおよび,ガングリオシド製剤の末梢神経炎患者への使用は中止となった.一方,日本,スウェーデン,アメリカ,ドイツ,フランスでは,細菌,ウイルス,細菌毒素の受容体に関わる糖脂質の研究が活発化し,毒素を介した細胞内シグナル伝達の仕組みの解明へとつながるとともに,コレラ患者に対するGM1コート活性炭による治療も行われた.1960~1980年代は,糖脂質の構造と血液型抗原,細菌受容体,腫瘍マーカー,代謝異常症の研究が急拡大した時代である.時を同じくして,糖タンパク質,プロテオグリカンの糖鎖構造の詳細が明らかになり,糖タンパク質糖鎖の非還元末端には糖脂質の一部の構造と同じ構造が含まれており,血液型抗原や細菌受容体としての活性を持っていることが示された.ヒト体内に含まれる複合糖鎖を構成している単糖は10種類,グルコース,ガラクトース,マンノース,N-アセチルグルコサミン,N-アセチルガラクトサミン,シアル酸,フコース,キシロース,グルクロン酸,イズロン酸であることが明らかになった.3分子の鎖状構造の場合,ATCG 4種の単位からなるDNAでは64通り,20種のアミノ酸単位からなるトリペプチドでは8,000通りの異なる構造があるのに対し,10種の単糖がグリコシド結合して作られる三糖の構造は還元性水酸基のアノマー配位も含むと112,000通りとなることから,より少ない分子でより多くの構造多型を生み出せることが糖鎖の特徴の一つでもある.このことは逆に,糖の構造解析の煩雑さにつながり,糖鎖研究が敬遠される理由の一つにもなっている.近年,構造解析の簡便迅速化を目指して,複合糖質の糖鎖を切り出し,蛍光もしくは紫外線吸収誘導体として液体クロマトグラフィー質量分析計で測定する方法が普及しており,既知構造であれば糖鎖の構造解析は以前と比べ,はるかに容易になっている.また,糖脂質については,その免疫原性の強さから,ほぼすべての構造に対する抗体プローブが作製されており,標準糖脂質を併用して免疫的検出を行うことによりngレベルの構造解析と定量が可能となっている.1990年代に入ると糖転移酵素遺伝子のクローニングが行われ,酵素分子の構造と基質特異性,細胞内分布の詳細が明らかになるとともに,ノックアウトマウスの作製を通じて糖鎖の機能を具現化する研究が進展した17, 18).哺乳類のスフィンゴ糖脂質合成経路の最初の反応をつかさどるセラミドグルコース転移酵素はIII型膜貫通タンパク質であり,ゴルジ体の細胞質側に活性部位を持つ.この酵素により細胞質側で糖が付加されたグルコシルセラミド(GlcCer)の一部は形質膜へ,大部分はフリッパーゼによりエネルギー非依存的にゴルジ内腔へ移動し,糖鎖が伸長する19).この酵素のノックアウトマウスは胎生7.5日に,外胚葉のアポトーシスが進行し,死亡する20).グルコースを付加できずに蓄積したセラミドがアポトーシスを引き起こすことから,グルコースの付加は毒性セラミドの解毒に関わっているようである.他にも,セラミド1-リン酸,スフィンゴシン,スフィンゴシン1-リン酸などスフィンゴ脂質の疎水性鎖の誘導体は細胞の分化,増殖,アポトーシスに関わるシグナル媒介分子と位置づけられ,それぞれの誘導体の合成に関わる遺伝子のクローニングとノックアウトマウスの作製を通じて機能解析が行われている21, 22).注目される知見は,スフィンゴシン1-リン酸受容体のアゴニストFTY720である.この薬剤は冬虫夏草から分離されたスフィンゴシンアナログMyriocinを基に合成された分子であるが,免疫抑制活性を持つことから,多発性硬化症の治療薬として用いられている23, 24).さらに,GlcCer合成酵素ノックアウトマウスの皮膚の異常,およびジヒドロスフィンゴシンN-アシル転移酵素のアシル鎖の違いで反応する異性体酵素の研究から,皮膚の糖脂質GlcCerは層板顆粒に蓄積され,角質セラミドの供給源となっていることが明らかになった25).最近の皮膚糖脂質研究は疎水性セラミド鎖の合成酵素の活性調節と糖鎖付加による脂質輸送,およびリン酸化,脱リン酸化を介したシグナル媒介分子としての役割,さらには皮膚角質層形成とバリア機能に重点を置き,創薬や美容を視野に置いている.一方,細胞膜を界面活性剤Triton X-100, CHAPS, Brij96などで処理した後,不溶性粒子として分離される画分(detergent resistant membrane)にカベオリン,GPI-アンカータンパク質,チロシンキナーゼに加え,糖脂質,コレステロール,スフィンゴミエリンが濃縮されることから,各種機能性タンパク質が集積し情報伝達のプラットフォームとしての脂質ラフト(lipid raft)あるいはミクロドメイン(microdomain)の概念が提唱された26–28).この概念はさらに拡大し,glycolipid-enriched membraneあるいはglycosynapseとして糖脂質の役割に重点を置き,アルツハイマー病,プリオン病,AIDSの病因を理解しようとする研究へと発展している29–32).しかし,脂質ラフトの分離方法の違いにより,粒子サイズと脂質組成に大きな違いがあり,糖脂質組成の違いから,uropod-raftとleading edge raftと区別して機能解析が行われているが,今後の課題は多い33–35).次いで糖脂質研究の転機になった知見は糖脂質欠損細胞GM-95の発見とGM2合成酵素ノックアウトマウスの作製である36, 37).GM-95によって,糖脂質が細胞の生存に必須でないことが示されるとともに,GM2合成酵素ノックアウトマウスによって脳に特徴的な糖鎖の長いガングリオシドは個体の発育に影響しないことが明らかになった.もっとも,GM2合成酵素ノックアウトマウスでは精神運動発育遅延,頭部,手足発育異常,肝,脾の肥大が認められるが,これは前駆体GM3の蓄積による症状と考えられている.GM3を唯一のガングリオシドとするGM2/GD3合成酵素ダブルノックアウトマウスも成熟可能であるが,15週目で死亡する38).一方,GM3合成酵素ノックアウトマウスは一年以上生存する39).このように脳ガングリオシドは,生存には関係なく,より複雑な高次神経機能に関与しており,単純な構造–機能相関の図式を当てはめて解析することが不可能であることが明らかになった.このことは糖鎖構造の多様性と同じく,脳ガングリオシド糖鎖が多様で複雑な機能に関わっていることを示している.これらの知見を契機として糖脂質糖鎖よりも疎水性側鎖セラミドやジアシルグリセロール(DG)の情報媒介分子としての役割,あるいは糖鎖遺伝子を中心とした分子生物学研究に重点を置いた研究へとシフトする研究者が相次ぎ,研究の分散化,他分野への移行の動きが起こり,従来の糖脂質の構造と機能を追及する研究は急速に衰退した.最近の生化学会,脂質生化学会,神経化学会,がん学会での糖脂質の構造と機能に関する研究発表は1970~1980年代の3分の1以下になっている.生物体を構成する分子には必ず構造的意味があり,進化の過程で獲得した機能と結びついている.疎水性と親水性構造を合わせ持つ糖脂質は分子量が小さく,巨大分子よりも小回りが利くと思われる.機能性タンパク質とは,あたかも界面活性剤のように非特異的にタンパク質の機能を修飾することも可能であり,さらには糖鎖あるいは疎水性鎖と特異的に作用することもできる.糖脂質分子の持つ化学的性質に着目し,新たな機能を探索する研究が求められている40).
古細菌,細菌,真核生物の糖脂質構造には大きな特徴がある.特に,疎水性側鎖は,古細菌の場合,グリセロールにイソプレン単位の炭化水素鎖がエーテル結合したarchaeol,あるいはcardarchaeolであり,側鎖相互の疎水性結合はきわめて強固な構造になっている41, 42).メタン生成細菌においては脂質二分子膜の内外層を連結したcardarchaeolの一方に糖が,他方にリン酸エタノールアミンが結合した構造も含まれる(図1).好塩菌,好熱菌においては内外層が分離したarchaeol, α-およびβ-hydroxy archaeol, cyclic archaeolが主要な構造となっている.側鎖のイソプレノイドは,好熱菌の赤色カロチノイド,バクテリオリュベリンと同じ合成経路にある43).シアノバクテリアのバクテリアパンテロール,酵母のエルゴステロール,テトラヒメナのテトラヒマノール,植物のフィトステロール,哺乳類のコレステロールとも類似の経路であり,進化の過程で代謝経路が変化していることを示している44, 45).古細菌糖脂質の糖結合位置はグリセロール1位であり,Glcα, Glcβ, Manαなどが結合した二糖糖鎖,および硫酸化二糖糖鎖が主要構造となっている42).
グラム陽性細菌の糖脂質疎水性側鎖はDGを基本構造としており,グリセロール1位と2位に結合する脂肪酸の種類として,直鎖飽和,不飽和,ヒドロキシ脂肪酸以外にも,イソ,アンテイソ,シクロプロパン,ω-シクロヘキシル,メチル分枝脂肪酸などを持つものがあり,それぞれの細菌の生息場所によって異なっている.また,DGの脂肪酸に加え,糖鎖に脂肪酸がさらに結合し3個の疎水性鎖を持つ構造,海綿と共生するMicrococcusの糖脂質のようにモノアシルグリセロールと糖に結合した2個の脂肪酸を疎水性鎖として持つ構造,放射能耐性Deinococcusのように,ホスファチジン酸にアルキルアミンが結合し,3個の疎水性鎖を持つ構造もある(図1).細菌糖脂質の糖の結合位置はグリセロール3位であり,二糖糖鎖を主要糖脂質とするグラム陽性細菌では細菌属に特徴的な糖鎖構造を持っている46).グラム陽性細菌の糖脂質の糖鎖は,細菌相互の認識や抗原として機能するのみならず,細胞壁成分であるテイコ酸を細胞膜に固定するリポテイコ酸としての役割も持っている.一方,グラム陰性細菌は細胞壁外膜にO抗原を固定する糖脂質としてGlcNAcにヒドロキシ脂肪酸が結合したリピドAがあり(図1),内毒素としても強力な生理活性を持っている.また,シアノバクテリア起源である葉緑体のチラコイド膜内膜にはGalβ1-3′DG,外膜にはGalα1-6Galβ1-3′DGが全脂質の80%の濃度で,さらにGalβ1-3′DGの6位Galαの繰り返し糖鎖や6位にリン酸,脂肪酸が結合した糖脂質,またスルホキノボースが結合したDG等が含まれている.DGの脂肪酸には,16 : 3, 18 : 3の割合が多い40, 41).同様に,マメ科根粒のグラム陰性細菌Rhizobiumにはシスバクセン酸を単一の脂肪酸とするDGにスルホキノボースが結合した糖脂質が最大成分として含まれている.一方,胃の酸性環境下で生息するHelicobacterの主要糖脂質は,Glcα 1位にコレステロール,6位にホスファチジン酸が結合しており,細胞膜に埋め込まれたDGとコレステロールをリン酸と糖で橋渡しする構造となっている.本菌にはコレステロールグルコシドも含まれており,その合成阻害剤は抗菌剤として期待されている(図1).さらに,広義には,ステロイド,トリテルペノイド,フラボノイドに糖が結合した配糖体も糖脂質といえる.植物配糖体はGlcやグルクロン酸が二糖結合した構造が多い.動物においては,配糖体の疎水性ステロイドに糖が付加されることによって水になじみやすくなり,界面活性剤,ステロイドの吸収,排出,輸送,さらには糖転移酵素の前駆体としての役割も持っている.細胞機能に直結した働きも持っており,たとえば,繊維芽細胞のコレステロールグルコシドは熱ショック応答,酵母のスチグマステロールグルコシドは分裂,増殖に関わっている(図1).
真核生物およびProteobacteria属α4サブクラス,Sphingomonadales目の細菌にはセラミド鎖に糖が結合した糖脂質が含まれている.疎水性鎖の長鎖塩基はセリンと長鎖アルデヒドより合成され,また,セラミド鎖の脂肪酸は,脂肪膜を構成するリン脂質に比べると,6~8炭素長い構造であり,脂質二重層の外層と内層を橋渡ししている.これは親水性糖鎖を膜に固定する上で必要な構造であると考えられている.実際,哺乳類脳ガングリオシドでは脂肪酸は18 : 0がほぼ単一分子種であるのに対し,長鎖塩基はシアル酸数が多くなるにつれC20長鎖塩基の割合が多くなる40).脳GM4, GM3にはC20長鎖塩基は含まれていないが,GQ1bになるとC20長鎖塩基の割合が60%近くに達する.酵母や植物スフィンゴ糖脂質の長鎖塩基には,二重結合を2個持つものや,メチル基,水酸基で分子修飾を受けたもの47, 48),細菌スフィンゴ糖脂質にはスフィンガニン,シクロプロパン環含有C21長鎖塩基など多様な分子種が含まれている.長鎖塩基の分子種と生物機能についても遺伝子欠損や阻害剤による研究が行われており,フィトスフィンゴシンt18 : 0のC4水酸化酵素欠損植物は矮化,あるいは早期枯死49),セリンパルミトイルトランスフェラーゼSPT欠損植物も球状胚で致死50),スフィンゴシン類縁化合物フモニシンB1でセラミド合成を阻止すると雄性不稔になるなど51)長鎖塩基は植物細胞の分裂に不可欠の分子であることが示唆されている.図1に示すように,植物,酵母,ヒトのスフィンゴ糖脂質のセラミドはC18長鎖塩基であるのに対し,脂肪酸は鎖長C18~C30まで多様であり,細胞の種類や含有される組織によって特徴的である.酵母Saccharomycesのリン含有糖脂質の脂肪酸は26h : 0,酵母Kluyveromycesのリンを含まない糖脂質は18h : 0であるのは,上記脳ガングリオシドのシアル酸数と長鎖塩基鎖長の関係と同様の性質である可能性が高い.長鎖塩基に異なる鎖長の脂肪酸を転移するアシル転移酵素はアシルCoAの鎖長の違いで反応する6種類の酵素(CerS1~6)が知られている52).加えて,極長鎖脂肪酸合成酵素7種類(ELOV1~7)の組織分布が各組織に特徴的な糖脂質疎水性鎖の構造を決めている53).たとえば,ヒト皮膚に特徴的な糖脂質は図1に示すようなユニークな構造を持ち,長鎖塩基に鎖長C30程度のω-ヒドロキシ脂肪酸が結合し,さらにリノール酸18 : 2がω-水酸基にエステル結合している(図1)54).長鎖塩基にはスフィンゴシンd18 : 1,ジヒドロスフィンゴシンd18 : 0,フィトスフィンゴシンt18 : 0の3通りがあり,それぞれが皮膚角質アシルセラミドCer1, 4, 9の供給源となっている.また層板顆粒ラメラボディのGlcCer疎水性鎖も分子種多様性に富み,皮膚角質セラミドCer2, 3, 5~11の供給源,さらにスフィンゴミエリンはCer2, 5, 10の供給源となっている.角質セラミドの70%が糖脂質由来である55).アシルセラミドを持つGlcCerのリノール酸がリポキシゲナーゼにより過酸化を受けるとエステラーゼにより切断可能となる56).エステル切断後のω-水酸基がトランスグルタミナーゼIの関与でタンパク質に結合した後,糖が切断される57).ω-水酸基を持つセラミドは皮膚バリア機能に不可欠な角化不溶性膜corneocyte lipid-bound envelopeを形成し,結合水を保持し,−40°Cでも凍らない性質を付与している58, 59).
ヒト組織に含まれるグリセロ糖脂質として注目されているのが神経組織のホスファチジルグルコシドと精巣のセミノリピドである60, 61).両糖脂質の疎水性鎖はほぼ単一の分子種であり,前者の1位,2位脂肪酸は18 : 0, 20 : 0,後者は1位がバチルアルコール(16 : 0のエーテル結合),2位が16 : 0である(図1).スフィンゴ糖脂質とグリセロ糖脂質の大きな違いは,親水性糖鎖と疎水性側鎖の間にスフィンゴ糖脂質では–OH, –NH基などの水素結合の供与基および–C=O, –C–O–C–基などの受容基を合わせ持つが,グリセロ糖脂質では受容基のみである点である.この領域は脂質二分子膜の水素結合帯にあたることから,供与基を持たないグリセロ糖脂質は,膜に束縛されず自由度が高いと期待される.両糖脂質の組織分布,合成酵素遺伝子欠損動物を用いて機能解析が進められていて,グリセロ糖脂質でなければならない理由が明らかになると思われる.グリセロ糖脂質に比べ,スフィンゴ糖脂質の糖鎖は伸長し,多様な構造を形成する.糖鎖の合成反応はセラミド鎖に順次糖を付加する糖転移酵素の連続反応である.糖転移反応で合成された糖脂質が次の反応の基質となることから糖転移酵素の基質特異性が細胞と組織に特徴的な糖脂質の発現を決定している.140種類の糖転移酵素遺伝子が報告されているが,スフィンゴ糖脂質の基本糖鎖系列としては表1の14種が代表的な構造である.これら基本糖鎖系列に糖や硫酸基による修飾が行われ血液型や受容体としての機能を発揮する(http://jcbl.jp/wiki/Category:LBを参照).
表1 スフィンゴ糖脂質の基本糖鎖系列| 糖鎖系列 | 略号 | 基幹構造 |
|---|
| Globo | Gb | GalNAcβ1-3Galα1-4Galβ1-4Glcβ1-1′Cer |
| Isoglobo | iGb | GalNAcβ1-3Galα1-3Galβ1-4Glcβ1-1′Cer |
| Ganglio | Gg | Galβ1-3GalNAcβ1-4Galβ1-4Glcβ1-1′Cer |
| Isoganglio | iGg | Galβ1-3GalNAcβ1-3Galβ1-4Glcβ1-1′Cer |
| Lacto | Lc | Galβ1-3GlcNAcβ1-3Galβ1-4Glcβ1-1′Cer |
| Neolacto | nLc | Galβ1-4GlcNAcβ1-3Galβ1-4Glcβ1-1′Cer |
| Lactoganglio | LcGg | GalNAcβ1-4(GlcNAcβ1-3)Galβ1-4Glcβ1-1′Cer |
| Muco | Mc | Galβ1-4Galβ1-4Glcβ1-1′Cer |
| Gala | Ga | Galα1-4Galβ1-1′Cer |
| Neogala | | Galβ1-6Galβ1-6Galβ1-1′Cer |
| Mollu | Mu | GlcNAcβ1-2Manα1-3Manβ1-4Glcβ1-1′Cer |
| Arthro | At | GalNAcβ1-4GlcNAcβ1-3Manβ1-4Glcβ1-1′Cer |
| Schisto | | GalNAcβ1-4Glcβ1-1′Cer |
| Spirometo | | Galβ1-4Glcβ1-3Glcβ1-1′Cer |
糖脂質を細胞・組織より抽出し,シリカゲルを充填剤とする高速液体クロマトグラフィー(HPLC)で分離,あるいは薄層クロマトグラフィー(TLC)で分析するには各種有機溶媒を組み合わせて行う62).糖脂質の極性と類似の極性を持つ有機溶媒中では単分子分散しているが,水中ではヘキサゴナルI型のミセルを形成し,見かけの分子量は数十万になるため,透析膜や限外ろ過法で混在する塩類を除くことができる.逆に,ミセル形成は水系の反応で糖脂質の役割を解析する場合に大きな障害となる.特に,糖鎖の長さが異なると臨界ミセル濃度が異なり,受容体解析などで解離定数などを求める際は必ず臨界ミセル濃度以下で超音波処理を行い,単分子分散させなければならない.細胞の培養培地に添加する場合,糖脂質のエタノールやDMSO溶液を直接培地に加えるか,滅菌チューブに糖脂質のクロロホルム/メタノール(C/M)溶液を入れ,溶媒を除いた後,滅菌した培地あるいはアルブミン等のタンパク質溶液を加えて超音波分散させた後,添加する.ろ過滅菌法やオートクレーブ法は使えない.さらに,ガングリオシドのミセルでは共存するイオンがK+,Na+であれば親水性糖鎖を外に向けたヘキサゴナルI型構造であるが,Ca2+であれば逆転ミセルになるので注意する必要がある.
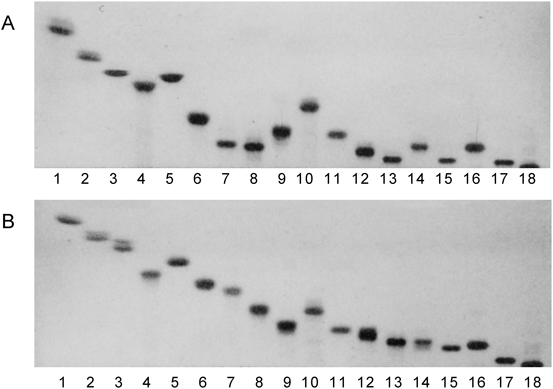
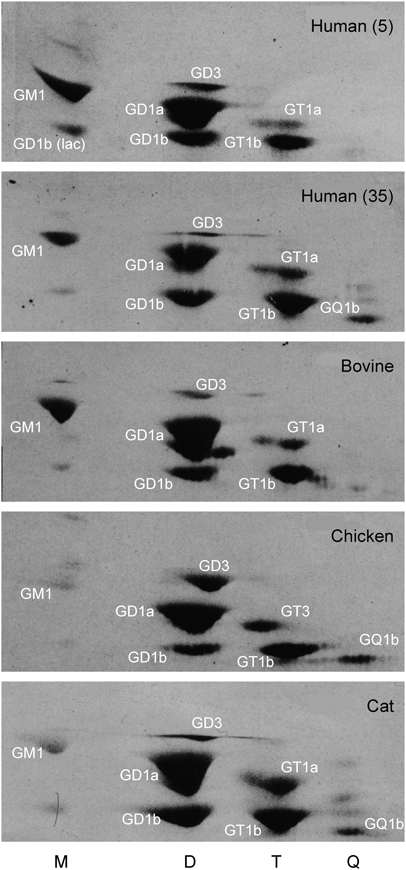
糖脂質の簡便同定法として汎用されているのがシリカゲルコートTLCである.シルカゲルのシラノール基との水素結合の強弱によってTLC上の移動度が制限されるため,基本的には糖脂質の極性の違いによって分離する.特にHPTLCを用いると,糖鎖が同じでも,疎水性側鎖の長鎖塩基と脂肪酸に付加された水酸基の数に応じて移動度が小さくなり,異なるバンドとして分離する.さらに脂肪酸の鎖長の違いでC24, C18, C16を主要分子種とするものも異なるバンドとして移動する.たとえば,脳ミエリンのGalCerのように,脂肪酸の鎖長がC14~C26,ヒドロキシ脂肪酸を含むと,最低でも6本のバンドを与える.糖エピマーの違いによっても分離し,同じセラミド鎖であってもGalCerはGlcCerよりも,Gg4CerはLc4Cerよりも移動度が小さい.GalやGalNAcの隣接水酸基がシラノール基とより強く反応するためである.一方,ガングリオシドの場合,展開溶媒にCa2+を加えるとバンドのまとまりがよくなり,またアンモニアを添加してシアル酸を解離させることにより,シアル酸数の違いにより分離するため,2種類の展開溶媒を用いて移動度を比較する.図2に示すように,ガングリオシドについては糖の数に加え,構造の違いも移動度に影響を与えていることがわかる.GD1bとGT1bは異なる構造であるにもかかわらず,NH4+溶媒では両者はほぼ同じ位置に移動し,Ca2+溶媒では前者の方が移動度は大きい.GM1(NeuAc)とGD3についても,NH4+溶媒では,GM1(NeuAc)の移動度の方が小さく,Ca2+溶媒ではGM1(NeuAc)の方が大きくなり逆転する.GM1の置換基の違い,Fuc-GM1とGalNAc-GM1についても,NH4+溶媒では前者の移動度の方が大きく,Ca2+では逆転して小さくなる.さらに,GD1aのシアル酸の違い,GD1a(NeuAc, NeuAc), GD1a(NeuAc, NeuGc), GD1a(NeuGc, NeuGc)はNH4+溶媒でよく分離するが,Ca2+溶媒では接近して移動する.これはNeuGcの方がNeuAcよりも陰性荷電が大きいことを示していて,同様の移動度の違いはGM1(NeuAc)とGM1(NeuGc)にもみられる.一方,両溶媒でのGT1aとGT1bの移動度を比較すると,シアル酸数が同じであるにもかかわらず,GT1bの方が極端に低い.Gg4Cerの内部Galにジシアル酸基が結合したGT1bの方が末端Galに結合したGT1aよりも,より強い陰性電荷を持つ.これはGg4Cer糖鎖のBay regionにジシアル酸が位置することにより,末端Gal-NeuAcと水素結合し,より強く解離しているためである40).また,ジシアル酸基を持つGD1b, GT1bはpH 2以下の酸性下で速やかにラクトンを形成し,1個の電荷を失う.形成されたラクトンはpH 8.5で元の2個の陰性荷電を回復する.つまりジシアル酸基は膜電荷を自動的に調節する能力を持っていることを意味している.ガングリオシドの電荷,極性,構造の違いは,ガングリオシドマッピング法により一挙に区別できる63, 64).図3に示すように,横軸に電荷,縦軸に極性をとり各種動物脳ガングリオシドをマッピング解析すると,各成分の相対濃度が直ちに判断できる.5歳と35歳のヒト脳を比較すると,35歳脳の方が5歳脳よりもGD3, GM1が低濃度であり,逆に,GT1a, GT1b, GQ1bが高濃度になっていることがわかる.また,異なる動物脳をヒト脳と比較すると,GD1a(NeuAc, NeuGc)はウシ脳にのみ含まれ,逆に,ウシ脳GQ1bはヒト脳よりも低濃度である特徴を持つ.さらに,ニワトリ脳には,GM1が痕跡程度で,GT1aはまったく検出できず,GD3, GQ1bはヒト脳よりも高濃度である.このようなヒトの発達に伴う,あるいは動物種によるガングリオシド組成の違いは,特定の神経機能の獲得のために既存の代謝活性を利用した結果であると考えられているが,構造とどのような機能が結びついているかは不明である.
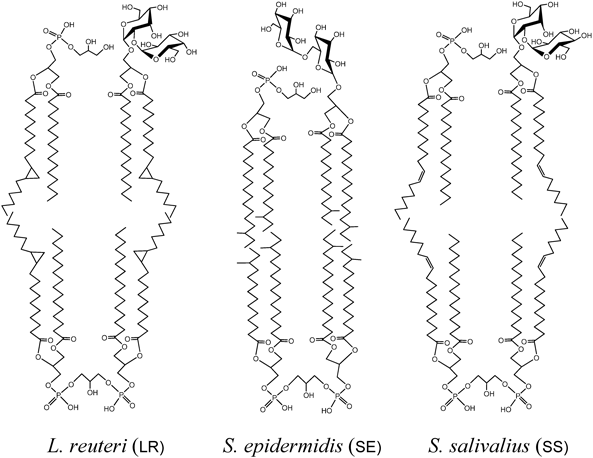
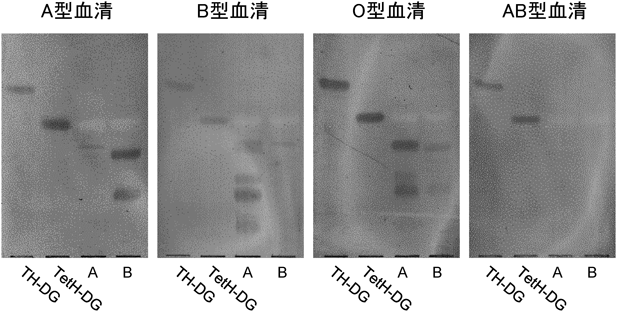
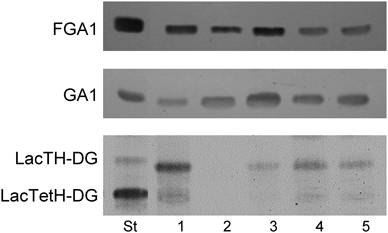
動物種や細菌属によって糖脂質が異なっていることは,糖脂質糖鎖を介した動物種や細菌属の相互区別と関わりがある.特に免疫において糖脂質は抗原として相手を認識する役割を持っていて,認識する側とされる側の組み合わせから,抗原となる糖脂質が判断できる.マウス受精卵,リンパ球サブセットの分化マーカーとして,表2に示す糖脂質が用いられている.それぞれの糖脂質に対する抗体は細胞の区別,機能解析に威力を発揮している.一方,動物種特異的糖脂質抗原は赤血球にみることができる.赤血球の主要糖脂質は,ヒトではGb4Cer,ウサギではIV4Galα-nLc4Cer,ヒツジではForssman,モルモットではGg3Cer,ラットではGM1, FucGM1, GD1aである65).ウサギを免疫動物として各動物赤血球に対する抗血清を作製し,動物種間の区別に用いられる糖脂質抗原を調べると,ヒツジとモルモット赤血球に対する抗血清は,それぞれの主要糖脂質Forssman, Gg3Cerと反応するが,抗ヒト赤血球抗血清はGb4Cerとまったく反応せず,微量中性糖脂質が抗原となっている66).同様にラット赤血球ではFucGM1に加え,6糖程度の微量中性糖脂質が反応し,GM1はFucGM1の1.7倍の濃度であるにもかかわらず,抗体は生成されない.このことは,たとえ微量成分であったとしても種を免疫認識するために優先的に用いられる構造が決まっていることを意味している.ヒト血清について各動物赤血球と体内の共生乳酸菌の糖脂質に対する自然抗体を調べると,約8割のヒトがForssmanに対する抗体を持ち,続いて,IV4Galα-nLc4Cer, Gg4Cer, Gg3Cerに対する抗体も高頻度に検出できる.ヒト血中の自然抗体は食事を通じて摂取する動物,植物,微生物,および共生細菌,あるいは感染によって体内に侵入した細菌に対する免疫応答の結果であると考えられている67).実際,ヒト血中に高濃度で検出される抗Forssman抗体が反応する糖鎖は肺炎球菌細胞壁多糖に含まれるForssman糖鎖に対する免疫反応の結果であると考えられている68).ヒト体内の乳酸菌と自然抗体の関係を,口腔のStreptococcus salivarius(SS),皮膚のS. epidermidis(SE),消化管のLactobacillus reuteri(LR)についてみると,ヒト血中にはLRのGalα1-6Galα1-2Glcα1-3′DG(LacTH-DG)とGalα1-6Galα1-6Galα1-2Glcα1-3′DG(LacTetH-DG)に対する抗体がForssmanに対する抗体と類似の抗体価および頻度で検出できる(図4)69, 70),生息部位の異なる3種類の乳酸菌はいずれもカルジオリピン(CL),ホスファチジルグリセロール(PG),二糖糖脂質を細胞膜主要脂質としており,二糖糖脂質は全複合脂質の21~28%ときわめて高濃度である70).リン脂質と糖脂質の疎水性DGは同じ分子種が用いられていて,それぞれの分子の空間充填モデルから細胞膜の構造を構築すると,図5に示すように,脂質二分子膜内層にCL,外層にPGと二糖糖脂質が分布していて,脂質組成,および分子種構成ともに真核生物に比べると単純,かつ合理的である.SSのDGはパルミチン酸(16 : 0)とシスバクセン酸(18 : 1)を主要脂肪酸としていて,飽和,不飽和脂肪酸の割合はヒト細胞のリン脂質の脂肪酸組成と類似であり,口腔内の温和な環境で生息するのに適している.SEのDGはアンテイソ15 : 0とアンテイソ17 : 0からなり,図5からも判断できるように,膜流動性はきわめて低い性質を持つ上,脂肪酸ω位のアンテイソ基が脂質二分子膜内層と外層を強固な疎水結合により結びつけ,水分の漏出を防ぐ構造となっている.この細胞膜構造は皮膚の乾燥した環境下に適応している.LRのDGは16 : 0とシスバクセン酸の二重結合がシクロプロパン環になった19 : 0を主要脂肪酸としており,消化管内の厳しい環境下で二重結合がラジカル化するのを防ぎつつ,一定の膜流動性を保持している構造である70).一方,1965~1975年の詳細な解析で明らかになっているように,二糖糖脂質の糖鎖構造はLRがGalα1-2Glcα1-3′DG(LacDH-DG),SEがGlcβ1-6Glcβ1-3′DG(StaDH-DG),SSがGlcα1-2Glcα1-3′DG(StrDH-DG)であり71–74),いずれの構造も細菌属特異的である.動物消化管の共生乳酸菌LR, L. johnsonii(LJ),L intestinalis(LI)には,LacDH-DGのGalα1-6で伸長した三糖糖脂質LacTH-DGと四糖糖脂質LacTetH-DGが含まれている(表3).前述のように,これらの糖脂質に対する抗体が75%のヒト血中に検出できることから,消化管内での増殖は許容しつつ,体内への侵入は免疫応答によって阻止する仕組みに関わっている可能性がある75).一方,L. murinus, L. casei, L. plantarumなどの発酵食品に利用される乳酸菌にはLacDH-DGにGlcβ1-6結合した三糖糖脂質LacβTH-DG,さらに糖鎖に脂肪酸が結合したLacβTH-DG-FAが含まれている(表3,図1)69, 76).L. murinusは細胞性,液性免疫応答が欠損した免疫不全scidマウス消化管の優勢乳酸菌である69).L. murinusが優勢であるscidマウスの糞便は強い酸性臭があり,下痢を伴うのに対し,正常マウスの糞便はLJが優勢であり,便の形状は米粒状固形であり,穀物臭がする.このような便の形状の違いが,乳酸菌の違いに帰属できるとすると,抗原糖脂質LacTH-DGやLacTetH-DGを持つ乳酸菌が宿主免疫系と共生関係を結ぶ資格を持っていると考えられる.しかし,消化管内には500種を超える細菌が生息し,互いに影響しあって増減しており,免疫と共生の仕組みについては,さらなる解析が必要である.免疫系による細菌糖脂質の認識に関しては,それぞれの細菌を直接免疫した抗血清の抗体価と各種糖脂質構造の交叉反応が参考になる.LR, LJ, LIをウサギに免疫した抗血清はLacTH-DG, LacTetH-DGときわめて強く反応し,約100分の1の反応強度でLacDH-DGと反応する77, 78).LIのLacTetH-DG含有量はLacDH-DGの40分の1の痕跡程度であるにもかかわらず,抗LI抗血清のLacTetH-DGに対する抗体価は抗LJ抗血清に匹敵することから,LacTetH-DGの抗原性の強さがわかる70).いずれのLactobacillus属細菌に対する抗血清もStaDH-DG, StrDH-DGと交叉しない.同様に,抗SE抗血清はStaDH-DGと強く反応し,StrDH-DG, LacDH-DGと反応しない.しかし,抗SS抗血清は,StrDH-DGのみならずStaDH-DG, LacDH-DGとも交叉する70).StrDH-DGのGlcαはデンプンの構築素材であり,消化酵素により容易に分解されることから,抗体価,特異性,ともに低い抗体が生成されるのに対し,StaDH-DGのGlcβはセルロースの構築素材であり,体内では分解を受けない糖であることから,特異性の高い抗体が生成すると考えられる.同様の理由でGalαで糖鎖伸長したLacTH-DGに対しても特異性の高い抗体が生成し,Glcβで伸長したLacβTH-DGよりも抗体価は高い.StaDH-DGに対する抗体を持っているヒトはきわめてまれであり,皮膚SEに対する抗体は生成されないと思われる.抗StaDH-DG抗体を持っているヒトは食中毒に関わるS. aureus等の消化管内感染を反映していると考えられる69).一方,味噌や醤油の発酵に用いられるTetragenococcus, Pediococcus属乳酸菌はSSと同じStrDH-DGが主要糖脂質であり,これらの菌に対しては強い免疫反応が起こらないことも,発酵食品として利用されている理由の一つと考えられる.糖脂質構造を基礎にした細菌属の分類は,従来の形態,選択培地,酵素活性による分類に加えて,有用な分類指標を提供する可能性がある(表3).しかし,過去の報告にみられる糖脂質構造には再確認を必要とするものがあり,近年汎用されている16SリボソームRNAの1400R, 300R領域とペプチドグリカンの種類による細菌の確定と糖転移酵素遺伝子と糖鎖構造の関係の二つを再検討することが求められている79, 80).一方,グラム陽性細菌の二糖糖脂質の基本的役割は,リポテイコ酸として細胞壁構造を形成することにある.実際,表3に示すように,二糖あるいは三糖糖脂質LacβTH-DG, StaDH-DG, StrDH-DGの非還元末端へキソース6位にリン酸ジエステル結合でグリセロールが結合した糖脂質が分離され,さらにStrDH-DG非還元末端に23個のリン酸–グリセロールの繰り返し構造が結合した糖脂質も分離されている.リポテイコ酸とペプチドグリカンからなる従来の細胞壁モデルからは,糖脂質が細胞壁に覆われ免疫認識に関わることは考えにくい.しかし,ウサギ抗LJ抗血清によるLJの凝集はLJ脂質で作製したリポソーム,およびLacTH-DG, LacTetH-DG-リポソームで65%まで阻止できることから,抗原糖脂質LacTH-DG, LacTetH-DGが部分的に露出している可能性がある.ちなみに,抗ヒツジ赤血球抗血清の溶血活性をForssman糖脂質含有リポソームで阻止できるのは75%までである66).図6に示すように,LacTH-DG, LacTetH-DGに対する自然抗体はA型およびB型糖脂質に対する自然抗体と同程度の反応強度であるが,これら糖脂質に対する抗体を持っているヒトの腸内細菌の種類および健康状態との関係は今後の課題である.また,ABO血液型に対する抗体も腸内細菌由来と考えられるが,該当する細菌の特定には至っていない.一方,細菌糖脂質は免疫調節活性を持つことが示されている.海綿Agelas mauritianusより分離されたGalα1-1′Cer(KRN 7000, agelasphins)は抗原提示細胞のCD1dに結合し,NKT細胞(Vα14)に抗原提示し,INF-γを分泌し,Th1を刺激して抗腫瘍活性を,IL-4を分泌して抗自己免疫応答を賦活することが示されている81, 82).Galα1-1′Cerは海綿に共生する細菌由来と考えられていて,さらにグラム陰性細菌Borrelia burgdorferiのGalα1-3′DG(BbGL-II)もGalα1-1′Cerと同等の活性を持つことが明らかになっている83–85).Glcα1-1′Cerも活性を持つがManα1-1′Cerは不活性である86).表3に示す細菌の中にはヒト体内に共生している菌や発酵食品として摂取している菌もあり,多くの菌の共通代謝中間体Glcα1-3′DGやGalαを含むLacDH-DGはKRN7000と同様の免疫調節能を持つ可能性がある87).
表2 糖脂質と分化マーカー| 分化マーカー | 糖脂質 |
|---|
| CD15(CD2のリガンド) | III3Fucα-nLc4Cer |
| CDw17 (cytolipin H) | LacCer |
| CD57 (HNK-1) | IV3(SO3-GlcUA)-nLc4Cer |
| CDw60 | 9-O-acetyl GD3 |
| CDw65 | X3NeuAcα, VII3Fucα-nLc10Cer, VIII3NeuAcα, V3Fucα-nLc8Cer |
| CD76 | IV6NeuAcα-nLc4Cer |
| CD77 (Pk) | Gb3Cer |
| SSEA-1 | III3Fucα-nLc4Cer, V3Fucα-nLc6Cer |
| SSEA-3 | Gb5Cer |
| SSEA-4 | V3NeuAcα-Gb5Cer |
| 分化マーカーの名称は与えられていないが,リンパ球サブセットの糖脂質マーカーについては数多くの研究が行われている.マウス免疫担当細胞の糖脂質マーカーはGalNAc-GM1b:T-lymphoblast, Gal-GalNAc-GM1b:T, Gg4Cer:NK, Gg4Cer/CD8, IL-12 responsive:IFN-γ producible prekiller T, Forssman:spleen macrophage, Gb4Cer:alloantigen-stimulated T, GD1a:Th2, GD1α:Th1, GD1c:naive T. |
表3 細菌に含まれる代表的な二糖以上の糖脂質| 細菌 | 構造 |
|---|
| Lactobacillus johnsonii, L. reuteri, L. intestinalis | Galα1-6Galα1-6Galα1-2Glcα1-3′DG (LacTetH-DG) |
| Galα1-6Galα1-2Glcα1-3′DG (LacTH-DG) |
| L. casei, L. murinus, L. plantarum | Glcβ1-6Galα1-2Glcα1-3′DG (LacβTH-DG) |
| Glcβ1-6Galα1-2Glc(6-FA)α1-3′DG (LacβTH-DG-FA) |
| Glc(6-P-Gro)β1-6Galα1-2Glcα1-3′DG |
| Glc(6-P-Gro)β1-6Galα1-2Glc(6-FA)α1-3′DG |
| Lactobacillus属 | Galα1-2Glcα1-3′DG (LacDH-DG) |
| Streptococcus pneumoniae | |
| Staphylococcus epidermidis, S. aureus, S. lactis, Bacillus subtilis, B. cereus | Glcβ1-6Glcβ1-3′DG (StaDH-DG) |
| B. aureus, B. subtilis, B. licheniformis | Glc(6-P-Gro)β1-6Glcβ1-3′DG |
| Streptococcus salivalius, S. pygenes, S. lactis, S. hemolyticus, Tetragenococcus halophilus, Pediococcus pentosaceus, Acholeplasma laidlawii | Glcα1-2Glcα1-3′DG (StrDH-DG) |
| Streptococcus group B, S. lactis | Glc(6-P-Gro)α1-2Glcα1-3′DG |
| Glc([6-P-Gro]n)α1-2Glcα1-3′DG |
| Glc(6-P-Gro)α1-2Glc(6-FA)α1-3′DG |
| S. lactis | Glcα1-2Glc(6-FA)α1-3′DG |
| S. pyogenes, S. faecium | Glcα1-2Glcα1-2Glcα1-3′DG |
| Mycoplasma pneumoniae | Galβ1-6Galβ1-3′DG, Glcβ1-6Galβ1-3′DG |
| Bifidobacterium bifidum | Glcβ1-2Galβ1-3′DG |
| Glcβ1-2Galf(3-FA)β1-3′DG |
| Glcβ1-2Galβ1-2Galβ1-3′DG |
| Acholeplasma modicum | Galα1-2Galα1-3Manhepβ1-3Glcα1-2Glc(?)1-3′DG |
| Pseudomonus diminuta | Glcβ1-4GlcUα1-3′DG |
| Streptomyces LA7071 | Galα1-4GlcUα1-3′DG |
| L. casei* | Glcα1-2Glc(6-FA)β1-3′DG |
| Glcα1-2Glc(6-FA)α1-2Glcα1-3′DG |
| Glcβ1-6Glcβ1-6Glcβ1-3′DG |
| Glcβ1-6Glcβ1-6Galα1-2Glcβ1-3′DG |
Gro:グリセロール,FA:脂肪酸,f:フラノース,GlcU:グルクロン酸,P:リン酸.
*報告されている構造については再検討が必要である. |
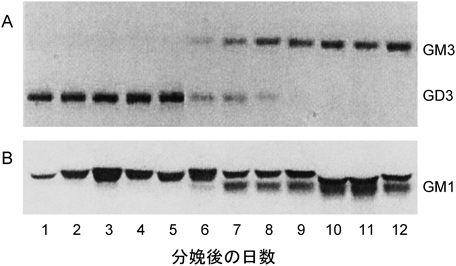
前述したように,糖脂質の細菌ウイルスおよび細菌毒素受容体としての役割は血液型をはじめとする抗原としての役割と並行して研究が行われてきた.糖脂質糖鎖は細胞膜上に,糖タンパク質糖鎖は細胞膜から離れた位置に分布しているため,細胞や組織内に侵入して生理活性を発揮する細菌ウイルスや毒素は糖脂質を受容体として結合する方が都合がよい.毒素活性部位(A)と受容体結合部位(B)からなるAB型毒素は糖脂質受容体に結合後の毒素活性の発揮の仕組みが明らかになっている.たとえば,コレラ毒素は5個のBサブユニットと1個のAサブユニットが疎水結合していて,BのGM1に対する結合親和性は非常に高く,ヒト消化管のようにGM1含有量が0.1 µg/mg乾燥組織以下の微量であっても強力な毒素活性を発揮する.BサブユニットがGM1に結合するとBサブユニットの構造変化が起こり,Aサブユニットが細胞内に入る.細胞内に入ったAサブユニットはGタンパク質αをポリADPリボシル化,続いてアデニル酸シクラーゼを活性化し,cAMP濃度が上昇する.その結果,イオン透過性が変化し,水分が多量に分泌され,水様下痢,脱水症状を引き起こす88).細胞のタンパク質をGM1糖鎖で化学修飾すると,Bサブユニットは結合するが,結合位置が細胞膜から離れておりAサブユニットが細胞内に入らないため毒性が出ない.一方,ボツリヌス毒素A型の場合,シナプス前膜のGQ1bに結合後,エンドサイトーシスによって取り込まれ,酸性下,Zn結合性プロテアーゼ活性を持つ活性サブユニットが生成する.プロテアーゼは細胞膜のSNAP-25(synaptosomal-associated protein-25)を切断し,シナプス小胞の膜融合を妨害し,神経伝達物質の放出を阻止する.同様に,E型もSNAP-25を切断するが,BDFG型はシナプス小胞のSynaptobrevin, C型はSyntaxinとSNAP-25を切断し,同じくシナプス小胞の膜融合を妨害し,神経筋接合部での神経伝達を阻止する89).ボツリヌス毒素とよく似た破傷風毒素の場合,GD1bに結合しエンドサイトーシスで細胞内に取り込まれた後,ボツリヌス毒素のように直ちに分解されず,軸索に沿って逆行性輸送される.脊髄,海馬に到達すると運動抑制ニューロンに作用し,重症の場合けいれん発作を引き起こす90).コレラやボツリヌスは消化管経由で体内に侵入するが,それぞれの毒素の受容体を含む食材は毒素活性を中和する作用を持っている.ヒト,ウシ乳の脂肪球皮膜には100 mLあたり0.4~0.7 nmol GM1が,ヤギ乳には100 mLあたり8.1 nmol GM1と2.9 nmol GQ1bが含まれ新生児を保護している91).ヒト乳脂肪球においては初乳から常乳にかけてGD3からGM3への主要ガングリオシドの大きな変化が起こるが,GM1含有量はほぼ一定である(図7)91).一方,マウス乳においてはGD1αが脂肪球皮膜の主要ガングリオシドであり,a経路からα経路への代謝変化が妊娠後急激に進行するが,乳中のGM1含有量はヒト乳と同様に一定のレベルで維持されている92).脂肪球皮膜のガングリオシドはそのシアル酸酸性により脂肪球相互の凝集を阻止するのが本来の役割である.また,ヒト初乳に含まれるGD3については強酸性ジシアル酸基が腸内環境を酸性に変え,Bifidobacteriumを優勢にし,E. coliなどのグラム陰性細菌を抑制する働きがある.同時に,受容体活性を持つガングリオシドは消化管への毒素の結合と競合することにより新生児を保護する役割を担っていると思われる.表4に示す毒素がそれぞれの糖脂質に結合することが明らかになっている.一方,細菌が糖鎖受容体に結合し細菌叢を形成する場合,細胞膜から離れた糖タンパク質糖鎖の方が都合がよいように思われる.実際,大腸菌,乳酸菌,サルモネラ菌の繊毛は糖タンパク質糖鎖のManを受容体としていて繊毛に含まれるアドヘシン,I型線毛やflagellinと糖の結合分子の立体構造も明らかになっている93, 94).表4の糖脂質を受容体とする細菌,ウイルスについては,非還元末端糖鎖が糖タンパク質と共通構造である場合もあるが,糖脂質を受容体とすることで宿主細胞とより密接に接触し,共生関係や感染を成立させていると考えられる.とりわけ,宿主細胞内に侵入するウイルスにとっては細胞膜上の糖脂質への結合が好都合といえる.
表4 細菌毒素,細菌,ウイルスの糖脂質受容体| 細菌毒素 | Vibrio cholerae | GM1 |
| V. parahaemolyticus | GT1b |
| C. tetani | GD1b |
| C. botulinum A, E | GQ1b |
| B, C, F | GT1b |
| B | GalCer |
| hemagglutinin | GM4 |
| C. perfringens | GM2 |
| C. difficile | IV3Galα-nLc4Cer |
| Sigella dysenteriae | Gb3Cer |
| E. coli | GM1 |
| E. coli (Vero toxin) | Gb3Cer |
| 細菌 | E. coli P | Gb3Cer |
| S | GM3 |
| F | Forssman |
| K99 | GM3 (NeuGc) |
| L. johnsonii, B. bifidum, | Gg4Cer (GA1) |
| A. naeslundii, N. gonorrhoeae | Gg4Cer (GA1) |
| P. aeruginosa | Gg4Cer (GA1) |
| Propionibacterium | LacCer |
| S. saprophyticus | nLc4Cer |
| S. pneunoniae | nLc3Cer |
| H. pylori | Lc4Cer, I3SO3-GalCer, Leb,Sialyl dimeric Lex |
| ウイルス | Influenza A, B | IV3NeuAc-nLc4Cer, IV6NeuAc-nLc4Cer |
| C | IV39-O-Ac-NeuAc-nLc4Cer |
| Sendai HVJ | GD3 |
| New castle | IV3NeuAc-nLc4Cer |
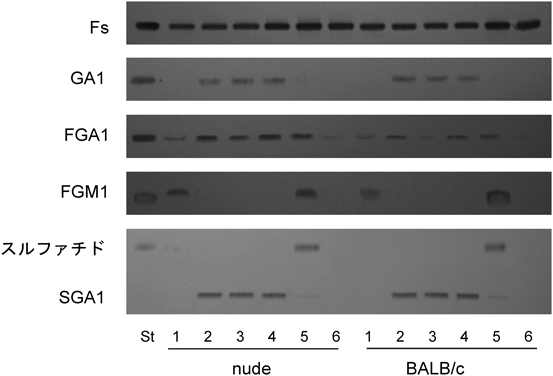
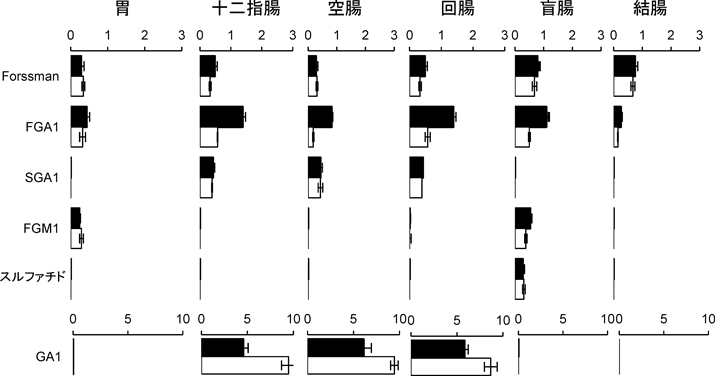
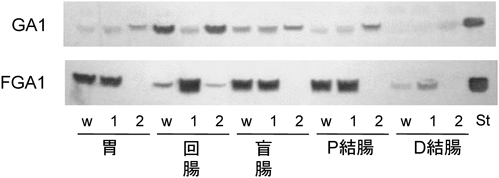
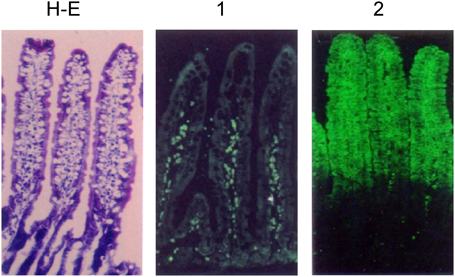
受容体糖脂質の組織分布から共生と感染の関係がある程度判断できる.ガングリオ系列の骨格Gg4Cer(GA1)は乳酸菌,Bifidobacteriumなど消化管共生細菌の受容体である(表4).マウス消化管においてGA1は小腸に限定して分布していることから,共生細菌の生息部位は小腸であると予想できる(図8).小腸にはグロボ系列の糖脂質Gb4Cer, Forssmanも含まれているがGA1のセラミド鎖の構造はフィトスフィンゴシン,α-ヒドロキシ脂肪酸であるのに対し,グロボ系列糖脂質はスフィンゴシン,直鎖脂肪酸であり,GA1は上皮組織に,Forssmanは間質組織に分布していることが明らかになっている95).一般に,マウス組織については消化管のみならず胸腺などの免疫組織,子宮,精巣などの生殖組織においてもForssmanが間質に分布しており,Forssmanを基準に上皮組織における糖脂質の変化を把握することができる.図8,図9に示すように,一定量の乾燥重量あたりの糖脂質をTLC分析すると,Forssman含有量は消化管全域でほぼ一定であるのに対し,他の糖脂質は部位特異的分布を示すことが明瞭に把握できる78).I3SO3-GalCerは盲腸,FGM1は胃と盲腸,GA1とIV3SO3-Gg4Cer(SGA1)は小腸,IV2Fucα-Gg4Cer(FGA1)は全組織に分布している77).FGA1はGA1にFucαを転移して合成されるので,胃,盲腸,結腸においてはGA1を残さずフコシル化し,GA1の受容体活性を完全にマスクしていることを示している.小腸のGA1は他の部位よりも高濃度であり,フコシル化と硫酸化も完全には起こらず,一定範囲内のGA1発現量は維持されている(図8,図9).フコース転移酵素遺伝子(Fut)をクローニングしたところ,マウス消化管にはFut-1(ヒトH遺伝子),Fut-2(ヒトSe遺伝子),Fut-3(ヒトSec-1遺伝子)が検出できるが,Fut-3は不活性である96, 97).さらに,Fut-1, Fut-2遺伝子ノックアウトマウス消化管各部のGA1, FGA1発現量から消化管各部における遺伝子発現を調べると,図10に示すように,Fut-1欠損マウスの胃,盲腸,結腸のFGA1は変化せず,Fut-2欠損マウスではFGA1は消失し,相補的に基質GA1が増加していることから,これらの組織においてFut-2がFGA1の合成を行っていることがわかる.一方,小腸においては,Fut-1, Fut-2欠損マウスともにFGA1は消失せず,両遺伝子ともにFGA1合成に関わっていることを示している(図10の回腸w, 1, 2).Fut-1欠損下,Fut-2遺伝子のみがFGA1合成を行っている状況下ではFGA1は野生型マウスの5倍,GA1は1/5になっていて,GA1のフコシル化が促進している97).DNA上の両遺伝子はイントロンを含まず数十bpの距離でタンデムに配列しており,消化管各部位における両遺伝子の発現調節が課題となっている.小腸におけるGA1のフコシル化は共存する細菌によっても調節されている.無菌状況下で飼育されたマウス,あるいは抗生物質投与マウスでは十二指腸,空腸部でFGA1が消失し,GA1が最大限発現し,GA1を受容体とするLJやB. bifidumの結合を促している98, 99).無菌マウスに通常飼育マウス糞便懸濁液,あるいはindigenous filamentous bacteria, Bacteroides thetaiotaomicronを投与すると,6時間でフコース転移酵素活性が検出され始め,約48時間でFGA1量が最大となる.細菌によって小腸部に誘導される遺伝子はFut-2であり,また,FGA1の発現部位は絨毛上半分である(図11)95, 96).前述のように,scid, nude, pIgR(−/−)などの免疫不全マウスにおいてはLJなどの通常飼育マウスの共生細菌との共生関係が破綻し,L. murinusが優勢となり,図8,図9に示すように,Fut-2によるFGA1の合成が亢進している.したがって,Fut-2の誘導は免疫担当細胞の細菌に対する応答の結果ではなく,細菌による転写制御あるいは上皮細胞のストレス応答である.フコース転移酵素の誘導は離乳期以降の現象であり,授乳期にはシアル酸転移酵素が非還元末端糖鎖の修飾を行っていることから発達に伴う腸上皮細胞の糖鎖変化は授乳期から離乳期以降の共生細菌の選別に関わっている.いずれにしても,特定の細菌は受容体GA1をフコースでマスクすることにより共生細菌の生着を妨害し,自らの優位性を確保する結果となり下痢の発症など消化活動に甚大な影響を与えることになる.このことからもFut-2欠損マウスの共生細菌に興味が持たれる.
消化管上皮の古い細胞は脱落し常に新しい細胞へと置換されている.消化管各部の消化管内容物を活発な摂食行動から約5時間後に調べると,全内容物の35%は盲腸に,46%は結腸に移行し,消化活動はほぼ終了している100, 101).エサに含まれているトリアシルグリセロールとリン脂質は空腸部でほぼ完全に分解され,遊離した脂肪酸は胆汁酸とともに回腸で吸収され盲腸内容物中には含まれていない.しかし,エサのGlcCer,上皮細胞のGlcCer, GA1は分解を受けることなく排泄されている.GlcCer, GA1は盲腸結腸内容物そして糞便の主要糖脂質である.糞便中にはFGA1も含まれるがSGA1, FGA1はほとんど含まれておらず,硫酸基,シアル酸基は分解されるがフコースの分解率は低い.しかし,GlcCerのβ-グルコシダーゼ,GA1のβ-ガラクトシダーゼは消化酵素および共生細菌の酵素にも含まれていないため分解を受けない.全消化管内容物中のGA1とFGA1含有量は全組織中の含有量のそれぞれ約12.8%,2.5%に達していて,この値は上皮細胞の脱落と置換速度を反映している(図12).糞便中のGA1を受容体とする乳酸菌LJは乳酸菌選択培地で培養可能な細菌の20%を占めており,この菌のLacTetH-DG含有量を基に菌数を求めると,盲腸,結腸糞便の1 mg乾燥重量あたりの菌数は1.5~1.6×106個とほぼ一定であり,マウス1匹あたりの盲腸,結腸の総菌数は約108個である(図12).盲腸内にはLJ 1個あたり1.6×108倍の大過剰のGA1分子が含まれていて,細菌は受容体GA1に結合したまま排泄される.上皮細胞に結合した菌は上皮細胞の脱落に呼応して消化管内で拡散することなく排泄され置換された細胞に新たな細菌叢を形成することが期待される.一方,T細胞免疫不全nudeマウス,TB免疫不全scidマウス,分泌型IgA分泌不全pIgR(−/−)マウスでは前述のように共生乳酸菌の種類が変化している.液性免疫不全のscid, pIgR(−/−)マウスではLJが消失し,L. murinusが優勢となっていてFut-2によるGA1のフコシル化は小腸のみならず消化管全域で亢進している(図8,図9)69, 75, 77).scidマウスでは下痢のため,小腸,盲腸の水分量が多く食物の移動が遅く全内容物の40%が胃に滞留し,食欲不振を起こしている.共生細菌の種類が消化活動にいかに重要であるかがわかる.マウス消化管の細菌受容体糖脂質の構造修飾,細菌糖脂質に対する免疫認識は共生と感染の仕組みを明らかにする上で大変よい動物モデルになると思われる.
ヒトの糞便にも多量の糖脂質が含まれている.離乳前はGlcCer, GM3, Leaが主成分であり,離乳後はLacCerが急増しLeaは低下する.この変化は腸内細菌のシアリダーゼ,フコシダーゼによってもたらされていて,マウスのように顕著な上皮細胞の糖脂質変化は観察されていない102).一方,母乳と人工乳を摂取した新生児の共生細菌の違いがアレルギーや自己免疫の発症と関係していることから,ガングリオシド添加ミルクを用いて糞便細菌叢の改善を図る研究が活発に行われている.ヒト初乳のGD3の効果と同様に,脳ガングリオシド添加ミルクによりBifidobacteriumの増加とE. coliの低下が観察されていて,ガングリオシド投与は細菌叢を改善すると期待されている103).
糖脂質の構造・代謝・糖鎖遺伝子および機能に関する研究は日本が世界をリードしてきた分野である.したがって,標準糖脂質,糖鎖特異的抗体や毒素プローブ,分析や構造解析法に関する情報のほとんどは国内で入手可能であり,糖脂質の研究基盤は世界屈指である.新たな視点に立った糖脂質の機能研究がわが国から発信されることを期待する.誌面の都合上,多くの文献の引用を省略したことをお詫びします.
謝辞Acknowledgments
糖脂質について本格的に研究を始めることになったのは,永井克孝先生の研究室に加えていただいてからである.東京都老人総合研,東京大学での20年間は先生の厳格な哲学,豊かな学識,研究に対するこだわりにふれることができ,また,先生を通じて国内外に多くの知己を得ることができた.先生は第56回日本脂質生化学会の報告をさせていただいた後逝去された.先生のご指導に対し心より感謝申し上げます.
引用文献References
1) 山川民夫(1981)糖脂質物語(講談社学術文庫),講談社.
2) Aerts, J.M., Kallemeijn, W.W., Wegdam, W., Joao Ferraz, M., van Breemen, M.J., Dekker, N., Kramer, G., Poorthuis, B.J., Groener, J.E., Cox-Brinkman, J., Rombach, S.M., Hollak, C.E., Linthorst, G.E., Witte, M.D., Gold, H., van der Marel, G.A., Overkleeft, H.S., & Boot, R.G. (2011) J. Inherit. Metab. Dis., 34, 605–619.
3) Schepers, U., Glombitza, G., Lemm, T., Hoffmann, A., Chabas, A., Ozand, P., & Sandhoff, K. (1996) Am. J. Hum. Genet., 59, 1048–1056.
4) Smit, J.J., Schinkel, A.H., Oude Elferink, R.P., Groen, A.K., Wagenaar, E., van Deemter, L., Mol, C.A., Ottenhoff, R., van der Lugt, N.M., van Roon, M.A., et al. (1993) Cell, 75, 451–462.
5) Hakomori, S. (2003) Curr. Opin. Hematol., 10, 16–24.
6) Takahashi, T., Johnson, T.D., Nishinaka, Y., Morton, D.L., & Irie, R.F. (1999) J. Invest. Dermatol., 112, 205–209.
7) 斎藤政樹(1996)細胞工学,15, 737–744.
8) 中村充(2000)生化学,72, 451–455.
9) Saito, M. (1993) Adv. Lipid Res., 25, 303–327.
10) Crepaldi, G., Fedele, D., Tiengo, A., Battistin, L., Negrin, P., Pozza, G., Canal, N., Comi, G.C., Lenti, G., Pagano, G., Bergamini, L., Troni, W., Frigato, F., Ravenna, C., Mezzina, C., Gallato, R., Massari, D., Massarotti, M., Matano, R., Grigoletto, F., Davis, H., & Klein, M. (1983) Acta Diabetol. Lat., 20, 265–276.
11) Hallett, M., Tandon, D., & Berardelli, A. (1985) J. Neurol. Neurosurg. Psychiatry, 48, 1193–1207.
12) Nagai, Y., Momoi, T., Saito, M., Mitsuzawa, E., & Ohtani, S. (1976) Neurosci. Lett., 2, 107–111.
13) Kusunoki, S., Chiba, A., Kon, K., Ando, S., Arisawa, K., Tate, A., & Kanazawa, I. (1994) Ann. Neurol., 35, 570–576.
14) Okawa, S., Sugawara, M., Takahashi, S., Otani, T., Hashimoto, M., Kusunoki, S., & Ohnishi, H. (2013) Intern. Med., 52, 1121–1124.
15) Yuki, N. (2009) J. Neuroimmunol., 215, 1–9.
16) Lo, Y.L. (2007) Muscle Nerve, 36, 615–627.
17) Yu, R.K., Tsai, Y.T., Ariga, T., & Yanagisawa, M. (2011) J. Oleo Sci., 60, 537–544.
18) Hannun, Y.A. & Obeid, L.M. (2002) J. Biol. Chem., 277, 25847–25850.
19) Warnock, D.E., Lutz, M.S., Blackburn, W.A., Young, W.W. Jr., & Baenziger, J.U. (1994) Proc. Natl. Acad. Sci. USA, 91, 2708–2712.
20) Yamashita, T., Wada, R., Sasaki, T., Deng, C., Bierfreund, U., Sandhoff, K., & Proia, R.L. (1999) Proc. Natl. Acad. Sci. USA, 96, 9142–9147.
21) Merrill, A.H. Jr. (2002) J. Biol. Chem., 277, 2584325846.
22) Holleran, W.M., Takagi, Y., & Uchida, Y. (2006) FEBS Lett., 580, 5456–5466.
23) Miyake, Y., Kozutsumi, Y., Nakamura, S., Fujita, T., & Kawasaki, T. (1995) Biochem. Biophys. Res. Commun., 211, 396–403.
24) Payne, S.G., Oskeritzian, C.A., Griffiths, R., Subramanian, P., Barbour, S.E., Chalfant, C.E., Milstien, S., & Spiegel, S. (2007) Blood, 109, 1077–1085.
25) Holleran, W.M., Ginns, E.I., Menon, G.K., Grundmann, J.U., Fartasch, M., McKinney, C.E., Elias, P.M., & Sidransky, E. (1994) J. Clin. Invest., 93, 1756–1764.
26) Simons, K. & van Meer, G. (1988) Biochemistry, 27, 6197–6202.
27) Jacobson, K. & Dietrich, C. (1999) Trends Cell Biol., 9, 87–91.
28) Pike, L.J. (2004) Biochem. J., 378, 281–292.
29) Prinetti, A., Iwabuchi, K., & Hakomori, S. (1999) J. Biol. Chem., 274, 20916–20924.
30) Hakomori, S. (2004) An. Acad. Bras. Cienc., 76, 553–572.
31) Simons, K. & Ehehalt, R. (2002) J. Clin. Invest., 110, 597–603.
32) Ariga, T. & Yu, R.K. (2005) J. Neurosci. Res., 80, 1–17.
33) Vyas, K.A., Patel, H.V., Vyas, A.A., & Schnaar, R.L. (2001) Biol. Chem., 382, 241–250.
34) Gómez-Móuton, C., Abad, J.L., Mira, E., Lacalle, R.A., Gallardo, E., Jiménez-Baranda, S., Illa, I., Bernad, A., Mañes, S., & Martínez-A, C. (2001) Proc. Natl. Acad. Sci. USA, 98, 9642–9647.
35) de Almeida, R.F., Loura, L.M., Fedorov, A., & Prieto, M. (2005) J. Mol. Biol., 346, 1109–1120.
36) Ichikawa, S., Nakajo, N., Sakiyama, H., & Hirabayashi, Y. (1994) Proc. Natl. Acad. Sci. USA, 91, 2703–2707.
37) Takamiya, K., Yamamoto, A., Furukawa, K., Yamashiro, S., Shin, M., Okada, M., Fukumoto, S., Haraguchi, M., Takeda, N., Fujimura, K., Sakae, M., Kishikawa, M., Shiku, H., Furukawa, K., & Aizawa, S. (1996) Proc. Natl. Acad. Sci. USA, 93, 10662–10667.
38) Kawai, H., Allende, M.L., Wada, R., Kono, M., Sango, K., Deng, C., Miyakawa, T., Crawley, J.N., Werth, N., Bierfreund, U., Sandhoff, K., & Proia, R.L. (2001) J. Biol. Chem., 276, 6885–6888.
39) Yamashita, T., Hashiramoto, A., Haluzik, M., Mizukami, H., Beck, S., Norton, A., Kono, M., Tsuji, S., Daniotti, J.L., Werth, N., Sandhoff, R., Sandhoff, K., & Proia, R.L. (2003) Proc. Natl. Acad. Sci. USA, 100, 3445–3449.
40) Iwamori, M. (2005) Hum. Cell, 18, 117–133.
41) Nishihara, M., Morii, H., & Koga, Y. (1987) J. Biochem., 101, 1007–1015.
42) Koga, Y., Nishihara, M., Morii, H., & Akagawa-Matsushita, M. (1993) Microbiol. Rev., 57, 164–182.
43) Lazrak, T., Wolff, G., Albrecht, A.M., Nakatani, Y., Ourisson, G., & Kates, M. (1988) Biochim. Biophys. Acta, 939, 160–162.
44) Krajewski-Bertrand, M.A., Milon, A., Nakatani, Y., & Ourisson, G. (1992) Biochim. Biophys. Acta, 1105, 213–220.
45) Raederstorff, D. & Rohmer, M. (1988) Biochim. Biophys. Acta, 960, 190–199.
46) Iwamori, M., Nakasa, M., Yamazaki, K., Iwamori, Y., Tanaka, K., Aoki, D., Adachi, S., & Nomura, T. (2012) Glycoconj. J., 29, 199–209.
47) Ohnishi, M., Ito, S., & Fujino, Y. (1983) Biochim. Biophys. Acta, 752, 416–422.
48) Takakuwa, N., Kinoshita, M., Oda, Y., & Ohnishi, M. (2002) FEMS Yeast Res., 2, 533–538.
49) Chen, M., Markham, J.E., Dietrich, C.R., Jaworski, J.G., & Cahoon, E.B. (2008) Plant Cell, 20, 1862–1878.
50) Chen, M., Han, G., Dietrich, C.R., Dunn, T.M., & Cahoon, E.B. (2006) Plant Cell, 18, 3576–3593.
51) Coursol, S., Fan, L.M., Le Stunff, H., Spiegel, S., Gilroy, S., & Assmann, S.M. (2003) Nature, 423, 651–654.
52) Levy, M. & Futerman, A.H. (2010) IUBMB Life, 62, 347–356.
53) Furland, N.E., Oresti, G.M., Antollini, S.S., Venturino, A., Maldonado, E.N., & Aveldaño, M.I. (2007) J. Biol. Chem., 282, 18151–18161.
54) Takagi, Y., Nakagawa, H., Matsuo, N., Nomura, T., Takizawa, M., & Imokawa, G. (2004) J. Invest. Dermatol., 122, 722–729.
55) Guillard, E., Tfayli, A., Manfait, M., & Baillet-Guffroy, A. (2011) Anal. Bioanal. Chem., 399, 1201–1213.
56) Zheng, Y., Yin, H., Boeglin, W.E., Elias, P.M., Crumrine, D., Beier, D.R., & Brash, A.R. (2011) J. Biol. Chem., 286, 24046–24056.
57) Uchida, Y. & Holleran, W.M. (2008) J. Dermatol. Sci., 51, 77–87.
58) Uchida, Y., Holleran, W.M., & Elias, P.M. (2008) J. Dermatol. Sci., 51, 37–43.
59) Holleran, W.M., Ginns, E.I., Menon, G.K., Grundmann, J.U., Fartasch, M., McKinney, C.E., Elias, P.M., & Sidransky, E. (1994) J. Clin. Invest., 93, 756–764.
60) Takahashi, H., Hayakawa, T., Murate, M., Greimel, P., Nagatsuka, Y., Kobayashi, T., & Hirabayashi, Y. (2012) Chem. Phys. Lipids, 165, 197–206.
61) Zhang, Y., Hayashi, Y., Cheng, X., Watanabe, T., Wang, X., Taniguchi, N., & Honke, K. (2005) Glycobiology, 15, 649–654.
62) 中村和生(2011)脂質分析(日本分析化学会編),丸善.
63) Iwamori, M. & Nagai, Y. (1978) Biochim. Biophys. Acta, 528, 257–267.
64) Nagai, Y. & Iwamori, M. (1980) Mol. Cell. Biochem., 29, 81–90.
65) Iwamori, M., Shimomura, J., Tsuyuhara, S., Mogi, M., Ishizaki, S., & Nagai, Y. (1983) J. Biochem., 94, 1–10.
66) Iwamori, M., Murata, M., Toyoda, M., & Iwamori, Y. (2009) Glycoconj. J., 26, 467–476.
67) 岩森正男(1992)糖鎖工学(バイオテクノロジー情報センター編),pp. 157–180,産業調査会.
68) Höltje, J.V. & Tomasz, A. (1975) Proc. Natl. Acad. Sci. USA, 72, 1690–1694.
69) Iwamori, M., Tanaka, K., Adachi, S., Aoki, D., & Nomura, T. (2015) J. Biochem., 158, 73–82.
70) Iwamori, M., Nakasa, M., Yamazaki, K., Iwamori, Y., Tanaka, K., Aoki, D., Adachi, S., & Nomura, T. (2012) Glycoconj. J., 29, 199–209.
71) Fischer, W., Schuster, D., & Laine, R.A. (1979) Biochim. Biophys. Acta, 575, 389–398.
72) Shaw, N. & Baddiley, J. (1968) Nature, 217, 142–144.
73) Shaw, N. (1970) Bacteriol. Rev., 34, 365–377.
74) Nakano, M. & Fischer, W. (1978) Hoppe. Seylers. Z. Physiol. Chem., 359, 1–11.
75) Iwamori, M., Sakai, A., Minamimoto, N., Iwamori, Y., Tanaka, K., Aoki, D., Adachi, S., & Nomura, T. (2011) J. Biochem., 150, 515–523.
76) Sauvageau, J., Ryan, J., Lagutin, K., Sims, I.M., Stocker, B.L., & Timmer, M.S. (2012) Carbohydr. Res., 357, 151–156.
77) Iwamori, M., Iwamori, Y., Matsumoto, S., Adachi, S., & Nomura, T. (2013) J. Biochem., 154, 541–549.
78) Iwamori, M., Shibagaki, T., Nakata, Y., Adachi, S., & Nomura, T. (2009) J. Biochem., 146, 185–191.
79) Woese, C.R., Kandler, O., & Wheelis, M.L. (1990) Proc. Natl. Acad. Sci. USA, 87, 4576–4579.
80) Schleifer, K.H. & Kandler, O. (1972) Bacteriol. Rev., 36, 407–477.
81) Kawano, T., Cui, J., Koezuka, Y., Toura, I., Kaneko, Y., Motoki, K., Ueno, H., Nakagawa, R., Sato, H., Kondo, E., Koseki, H., & Taniguchi, M. (1997) Science, 278, 1626–1629.
82) Montecucco, C. & Molgó, J. (2005) Curr. Opin. Pharmacol., 5, 274–279.
83) Farrar, J.J., Yen, L.M., Cook, T., Fairweather, N., Binh, N., Parry, J., & Parry, C.M. (2000) J. Neurol. Neurosurg. Psychiatry, 69, 292–301.
84) Iwamori, M., Takamizawa, K., Momoeda, M., Iwamori, Y., & Taketani, Y. (2008) Glycoconj. J., 25, 675–683.
85) Momoeda, M., Momoeda, K., Takamizawa, K., Matsuzawa, A., Hanaoka, K., Taketani, Y., & Iwamori, M. (1995) Biochim. Biophys. Acta, 1256, 151–156.
86) Karlsson, K.A. (1989) Annu. Rev. Biochem., 58, 309–350.
87) Neeser, J.R., Granato, D., Rouvet, M., Servin, A., Teneberg, S., & Karlsson, K.A. (2000) Glycobiology, 10, 1193–1199.
88) Davis, B.M. & Waldor, M.K. (2003) Curr. Opin. Microbiol., 6, 35–42.
89) Montecucco, C. & Molgó, J. (2005) Curr. Opin. Pharmacol., 5, 274–279.
90) Farrar, J.J., Yen, L.M., Cook, T., Fairweather, N., Binh, N., Parry, J., & Parry, C.M. (2000) J. Neurol. Neurosurg. Psychiatry, 69, 292–301.
91) Iwamori, M., Takamizawa, K., Momoeda, M., Iwamori, Y., & Taketani, Y. (2008) Glycoconj. J., 25, 675–683.
92) Momoeda, M., Momoeda, K., Takamizawa, K., Matsuzawa, A., Hanaoka, K., Taketani, Y., & Iwamori, M. (1995) Biochim. Biophys. Acta, 1256, 151–156.
93) Karlsson, K.A. (1989) Annu. Rev. Biochem., 58, 309–350.
94) Neeser, J.R., Granato, D., Rouvet, M., Servin, A., Teneberg, S., & Karlsson, K.A. (2000) Glycobiology, 10, 1193–1199.
95) Suzuki, A. & Yamakawa, T. (1981) J. Biochem., 90, 1541–1544.
96) Lin, B., Hayashi, Y., Saito, M., Sakakibara, Y., Yanagisawa, M., & Iwamori, M. (2000) Biochim. Biophys. Acta, 1487, 275–285.
97) Lin, B., Saito, M., Sakakibara, Y., Hayashi, Y., Yanagisawa, M., & Iwamori, M. (2001) Arch. Biochem. Biophys., 388, 207–215.
98) Iwamori, M. & Domino, S.E. (2004) Biochem. J., 380, 75–81.
99) Umesaki, Y., Okada, Y., Matsumoto, S., Imaoka, A., & Setoyama, H. (1995) Microbiol. Immunol., 39, 555–562.
100) Iwamori, M., Iwamori, Y., Adachi, S., & Nomura, T. (2013) Glycoconj. J., 30, 889–897.
101) Iwamori, M., Iwamori, Y., Adachi, S., & Nomura, T. (2011) Glycoconj. J., 28, 21–30.
102) Larson, G., Falk, P., & Hoskins, L.C. (1988) J. Biol. Chem., 263, 10790–10798.
103) Rueda, R., Sabatel, J.L., Maldonado, J., Molina-Font, J.A., & Gil, A. (1998) J. Pediatr., 133, 90–94.
著者紹介Author Profile
 岩森 正男(いわもり まさお)
岩森 正男(いわもり まさお)医学博士.
略歴三重県に生まれる.滋賀大学卒業.1973年ハーバード大学医学部ユニスケネディシュライバーセンター研究員.76年東京都老人総合研究所研究員.79年東京大学医科学研究所助手.81年東京大学医学部助手.86年東京大学医学部助教授,パリ大学サルペトリエル病院研究員.98年近畿大学理工学部教授.2015年同退職.
研究テーマと抱負糖脂質の構造多形が関わる生命現象を化学の観点から理解したい.
趣味バドミントン.