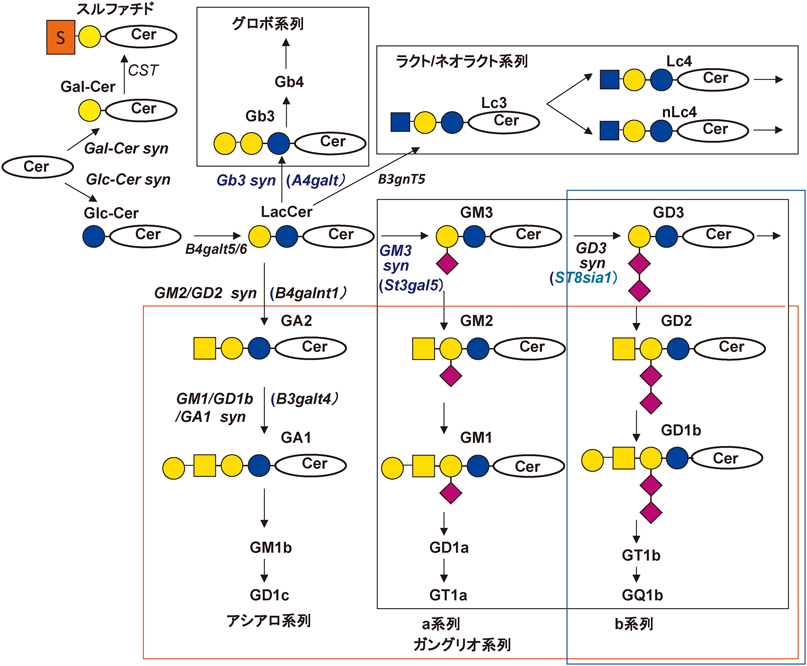
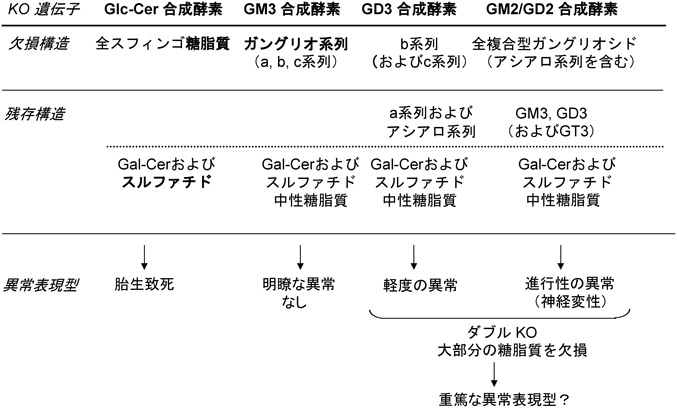
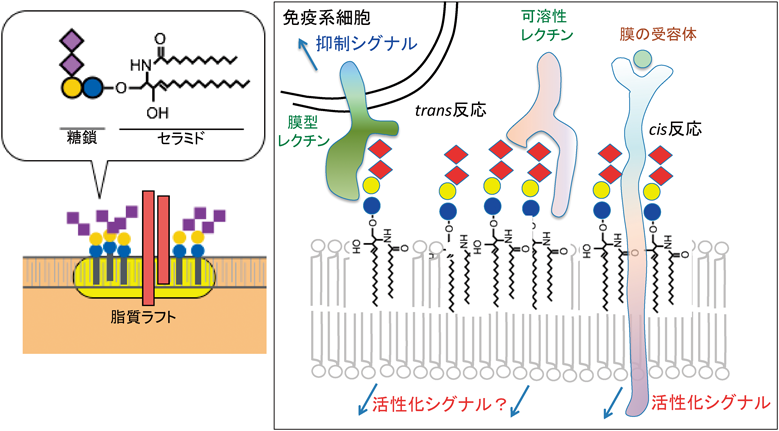
1)ジシアル化糖脂質とモノシアル化糖脂質との対照的な制御機能
スフィンゴ糖脂質は脊椎動物のおおむねすべての細胞や組織に発現する普遍的分子群であるが,細胞や組織の分化,老化,がん化等の状態変化に伴ってダイナミックな変化を示すことが知られてきた.中でも,がん化に伴う特徴的ながん性糖鎖発現に関して,Hakomoriらから多くの報告がなされてきた31).上記の腫瘍免疫学的な立場からも,多くのがん関連糖鎖の報告がなされ32, 33),糖鎖発現の変化のメカニズム34)が解析されてきた.また,その中のいくつかはがんの免疫治療の標的と考えられてきた35).しかしそれらのがん細胞における役割に関しては,糖鎖合成系の遺伝子が利用可能になってから,ようやく多くの説得力ある報告がなされてきた.
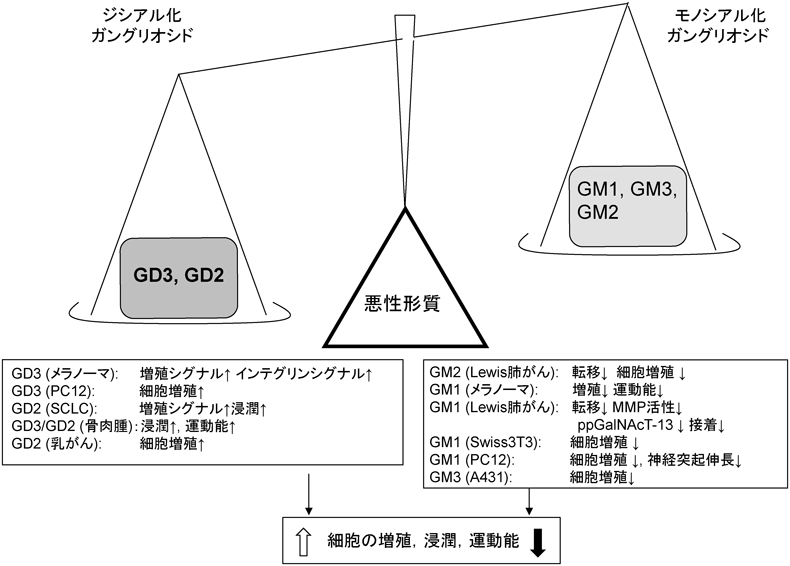
ガングリオシドはいくつかの神経外胚葉由来のがんや白血病のマーカーとして考えられてきたが36–39),特にメラノーマににおけるGD320, 23, 24),神経芽細胞腫40, 41),小細胞肺がん42, 43),骨肉腫44),乳がん45)そして転移性メラノーマ46)におけるGD2が,がんの悪性形質を増強することが示されてきた.一方,GM3やGM1等のモノシアル化ガングリオシドはがんの悪性形質の抑制に働くことが47)報告されてきた(図2).この,シアル酸の2個と1個の対照的な作用の違いのメカニズムはまだ明らかでないが,脂質ラフトまたはglycolipid-enriched microdomain(GEM)/ラフトにおけるスフィンゴ糖脂質の機能にシアル酸の数が大きく関わっていることが想定される48).
2)PC12細胞の増殖,分化に対する対照的な役割
ラットの褐色細胞腫由来PC12細胞に対して糖鎖リモデリングを行い,神経成長因子(nerve growth factor:NGF)に対する反応の変化を解析した.PC12はNGF刺激に対してRas/Raf/MEK/MAPKシグナルを介して神経突起の伸長を示す49)ため,神経分化のシグナル解析によく利用されてきた50).また,血清除去によってPC12細胞がアポトーシスを起こすときにGM1を添加すると細胞死を防止できることから,その神経栄養因子様の活性が期待されてきた51).また,NGFによる分化反応を促進することも報告された52).これらの外来性ガングリオシドの効果に対して,我々はcDNA導入による内因性糖脂質の増殖・分化調節機能を解析した.結果として,GM1/GD1b/GA1合成酵素遺伝子11)の導入では,NGFに不応性となり53),NGF受容体チロシンキナーゼであるTrkAおよび下流分子の活性化を認めなかった.さらにTrkAおよび他の関連シグナル分子が脂質ラフトから外方に移行した.おそらく,GM1レベルが過剰に亢進したことが,前報51, 52)との違いの要因と考えられた.すなわち,GM1の発現レベルが重要と考えられる.一方,GD3合成酵素cDNA9)の導入では,TrkAおよびErk1/2の恒常的活性化とNGF不応性が示され54),異常増殖も認められた.これらの結果は,GD3が優位に発現する神経幹細胞の状態を反映しているのかもしれない55).さらに,ガングリオシドが細胞のシグナルを制御して分化・増殖等の細胞運命をコントロールすることを示した.
3)ジシアル化ガングリオシドはさまざまながん細胞の悪性形質を増強する
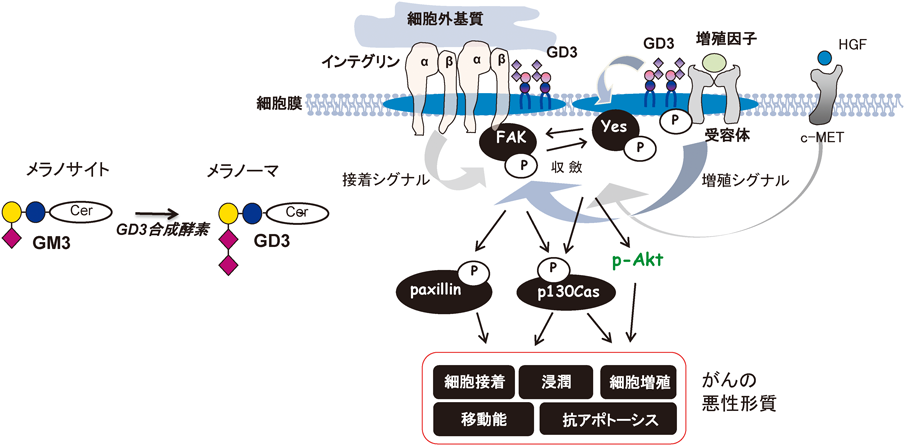
GD3やGD2(またはGM2)はメラノーマ関連抗原と考えられてきた56).これらに対してマウスモノクローナル抗体のみならず20, 57),ヒト由来抗体も25, 58)作製された.さらに,上述した糖転移酵素cDNAを用いたガングリオシドの機能解析が展開され59)たが,最初のGD3発現によるシグナル活性化の報告は,2005年に発表された60).GD3欠損メラノーマ株SK-MEL-28にGD3合成酵素cDNAを導入することにより作製したトランスフェクタントを用いて,GD3発現下でチロシンリン酸化を受ける分子を探索した.その結果,アダプター分子,p130Casおよびpaxillinが同定された60).さらに,focal adhesion kinase(FAK)もGD3発現下で活性化される重要分子として報告された61).一方,SrkファミリーキナーゼYesがGD3発現下で恒常的に活性化されることが判明し62),これらの分子が細胞膜上で分子複合体を形成することも明らかにされた63).よって,これらの分子がメラノーマ治療の分子標的となりうることが示されている64).これらの増殖因子/受容体を介するシグナルに加えて,細胞接着を介するシグナルもGD3発現下で増強するとともに65),p130Cas, FAKおよびpaxillinの活性化が接着シグナル存在下でのみ誘導されうることが示された66).また,血清刺激時に,GD3発現下でのみインテグリンが脂質ラフトに移行しうることが示され,GD3とインテグリン,その他のシグナル分子が脂質ラフトで協調して悪性形質を亢進するシグナルの生成に働くことが明らかになった.興味深いことに,肝細胞増殖因子(hepatocyte growth factor:HGF)受容体cMETは脂質ラフトに局在しないけれども,接着シグナルと協調してAktの活性化に働くことが示され67),ラフト内外のシグナルの収斂が悪性形質の増強に働くことも明らかにされた.これらの概要を図3に示す.
次にガングリオシドGD2に関して,いくつかの悪性腫瘍における機能解析の結果を列記する.まず,小細胞肺がん(SCLC)では,細胞株および患者の肺がん組織においてGD2の発現を認める.非小細胞肺がん(NSCLC)細胞では主にGM2が発現することはすでに報告があったが68, 69),SCLCの場合,GD3合成酵素が特徴的に発現することで,GD2の発現がみられた42).興味深い点は,抗GD2抗体の反応によってFAKのチロシンリン酸化が減少して,アノイキス(anoikis,細胞が足場を失ったことで誘導される細胞死のこと)に基づくアポトーシスが誘導されることであった70).この結果は,単なる抗体の結合のみでがん細胞の死を誘発できることを示し,抗GD2抗体のSCLCの治療応用に大きな期待を抱かせるものである.この抗体と化学療法剤の併用療法も良好な効果を示し,有望であることがわかった71).
また,GD2は乳がんに発現すると増殖度や浸潤度が亢進することが示された72).最近,GD2が乳がんの幹細胞のマーカーとなりうることが報告された73).GD2の作用機構として,HGF受容体cMETの活性化が示された72).一方メラノーマではGD3の発現がcMETを活性化することはなかった67).よって,ジシアル化糖脂質の作用機構は,細胞株の種類によって異なることが示唆される.メラノーマにおけるGD2発現の影響に関しては,現在検討中である.
骨肉腫においては,さらにガングリオシド発現の効果に違いがあることがわかった.以前に報告されたように44),多くの骨肉腫細胞株がGD2を発現する.骨肉腫細胞におけるジシアル化糖脂質の発現の影響を検討した結果,GD2/GD3の発現が細胞の浸潤性と移動度を増強し,またFAK, Lynの活性化を惹起して共通のターゲットであるpaxillinの活性化に至った.FAKとLynを同時にノックダウンすると,paxillinのリン酸化と細胞の浸潤性および移動性が完全に抑制された.これらのことから,骨肉腫では二つのシグナル系が同時に併行して活性化されることが示され,メラノーマのGD3のように細胞増殖がジシアル化糖脂質によって亢進することは示されなかった60).
これらの差異に加えて,GD3/GD2発現が腫瘍形質に及ぼす効果における興味深い違いが,RT-CES (real-time cell electronic sensing,金の電極上に細胞が接地することで起こる電気抵抗を経時的に測定することで,細胞接着度や進展度をリアルタイムに観察する装置,方法)にて測定した細胞接着において観察された.ある骨肉腫細胞株の四つの糖鎖発現タイプ(GD3+, GD2+, GD3+/GD2+, GD2−/GD3−)に関して,表現型とシグナル解析の結果を照合すると,GD3+/GD2+細胞はまったく細胞接着を示さなかったのに対して,「接着実験」中の細胞抽出液を用いたイムノブロットで,paxillinの最も強いリン酸化が認められた.つまり,paxillinのリン酸化の強さと細胞接着度が正反対の関係を示したことは,メラノーマの場合と対照的で66)興味深いが今のところ説明が困難である74).
神経芽細胞腫においては,GD2に対する抗体治療が広く試みられてきた.もっぱらヒト/マウスのキメラ抗体あるいはマウス抗体3F8が使用されてきたが,最近,サイトカイン75)あるいは放射線との併用76)も試みられている.主に寛解時に応用されて,5年生存率や疾患非再発期間延長の効果が報告されている77, 78).
4)がんの悪性形質に対するモノシアル化ガングリオシドの抑制作用
最初にGM1によるがん形質の抑制機能を観察したのは,マウスSwiss3T3細胞である.GM1合成酵素cDNA導入細胞は血小板由来増殖因子(platelet-derived growth factor:PDGF)に対する増殖反応が低下しており79),PDGF受容体の脂質ラフトからラフト外への移行が認められた.同時に,PDGF受容体のチロシンリン酸化レベルの低下も認められ,GM1によるシグナル抑制と考えられた.
ヒトの細胞においては,メラノーマ細胞株BDを用いた解析が詳細に報告された80).GM1合成酵素の過剰発現細胞では,細胞増殖と浸潤性の低下がみられた.GM1, GD1bの新規発現に伴って,脂質ラフトに大部分局在していたGD3が非ラフト画分に分散する傾向を認めた.興味深いことに,GM1合成酵素cDNA導入株においては,脂質ラフトにおける飽和脂肪酸含有ガングリオシドの比率が低下した.GM1と同様に脂質ラフトのマーカーとして頻用されているcaveolin-1のcDNA導入メラノーマ細胞株でも,GD3の細胞内局在に変化が認められたこと81)は大変興味深い.さらに,不飽和脂肪酸を含むGD3の比率が,非ラフト画分で増加した.すなわち,GM1とcaveolin-1はともに,脂質ラフトを介して伝達されるシグナルの抑制に働くと同時に,糖脂質の脂肪酸の飽和/不飽和の比を変化させて細胞内の局在パターンを調節しているように思われる.これらの調節の詳細なメカニズムの解明が待たれる.
5)モノシアル化ガングリオシドによるマウスLewis肺がんの転移性抑制
がんの転移はがん治療における最大の難問となっている.転移の克服が可能になれば,がんの治療成績は飛躍的に上昇するであろう82, 83).スフィンゴ糖脂質が直接あるいは間接的にがんの転移に関わるとの報告が以前よりなされているが,そのメカニズムは不明である.がんの転移は多くのステップからなっており84),単純なin vitroの実験系では解析が困難である.我々は糖脂質リモデリングを行ったマウス肺がんモデル85)を用いて,糖鎖の転移への関与を検討してきた.まず,GM2/GD2合成酵素遺伝子導入細胞では,肺がん転移が抑制されることがわかった86).FAKのリン酸化レベルの低下が認められ,GM1による接着シグナルの抑制機能が示された.
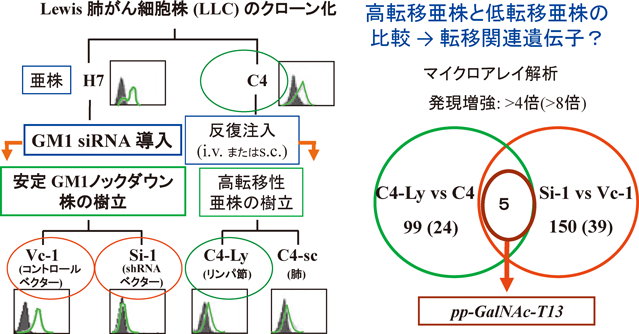
そこで,低転移性Lewis肺がん亜株を用いて,繰り返し注射(静注,皮下注)による実験的高転移性亜株をいくつか樹立し,低転移性株と比較することで転移関連遺伝子の同定を試みた.まず,主な細胞膜発現分子の中で唯一明らかな変化が認められたのは,高転移株におけるガングリオシドGM1の発現低下であった87).この事実から,GM1ががん転移を抑制することが示唆された.実際にGM1合成酵素を発現抑制すると,GM1低発現Lewis亜株は高転移性を示すことがわかった.すなわち,GM1発現の減少によりMMP-9やインテグリンが脂質ラフトに移行して,MMP-9の分泌と活性化を促進することが示された87).
これらの結果より,GM1およびGM1合成酵素が主な膜受容体の局在を変化させ脂質ラフトにおけるその機能を修飾することでがん形質を抑制することが明らかになった88).しかし,GM1の作用メカニズムはよくわかっていない.
さらに,Lewis肺がん細胞の高転移,低転移亜株を用いたDNAアレイ解析から,我々は転移に関わる糖転移酵素,ppGalAc-T13 (T13)を見つけ出した.このアレイ解析においては,GM1高発現(低転移)亜株と低発現(高転移)亜株との遺伝子発現プロファイル比較にも部分的に基づいたシステムでなされたので,GM1発現により制御される遺伝子群が含まれた89).さらに,他の基準で高転移,低転移亜株の間の比較を行って,双方で重複して同じ挙動を示す遺伝子をピックアップした.その中で,T13がGM1合成酵素発現抑制細胞,リンパ節高転移細胞亜株に共通して発現が亢進する遺伝子として選択された(図4).T13はO型糖鎖の合成開始点でGalNAc転移に働くppGalNAc-Tのファミリーメンバーである90).20メンバーのうち16遺伝子に酵素機能が確認されている91).T13は正常組織では脳に選択的に発現していた90).T13は三量体Tn抗原構造を合成することが大きな特徴である.Tn抗原自身は最も有名な腫瘍関連糖鎖であるが92, 93),その具体的な作用機構はよくわかっておらず,またがん転移における役割も不明であった.
三量体Tn構造は1989年に大腸がん細胞株で発見され94),大腸がんの悪性形質に関わることが報告された95).さらに我々は代表的な三量体Tnのキャリヤー分子としてシンデカン1を同定した96).T13 cDNA導入細胞で,インテグリン依存性にファイブロネクチンへの細胞接着が著明に亢進した96)ことから,三量体Tnを介するシンデカン1の結合によってインテグリンの機能が大きく増強されることが示唆された.さらに,高転移株においては,三量体Tn結合シンデカン1, MMP-9,インテグリンβ1/α5の三者の複合体が脂質ラフトで形成され,強い細胞接着による転移の促進が起こることが判明した.インテグリンを介するシグナル伝達に関しては多くの報告がある97–100).細胞外基質に細胞が接着したときに,FAKやSrcファミリーの活性化とp130Casやpaxillinの活性化が続いて起こる97).Lewis肺がんの場合,T13の発現下でFAKのリン酸化と引き続くpaxillinのリン酸化が観察された.
結局,GM1合成酵素遺伝子のノックダウンでT13の発現亢進が誘導されたことから,GM1を介するシグナルがT13遺伝子の発現制御に働くことが示唆されたが,その機構はまだわかっていない.また,その他のヒトがんにおけるT13の役割に関しては,神経芽細胞腫の骨髄転移における高発現の報告101)以外には報告がない.
引用文献References
1) Klenk, E., Vater, W., & Bartsch, G. (1957) J. Neurochem., 1, 203–206.
2) Hakomori, S. (1985) Cancer Res., 45, 2405–2414.
3) Handa, S. & Yamakawa, T. (1964) Jpn. J. Exp. Med., 34, 293–304.
4) Narimatsu, H., Sinha, S., Brew, K., Okayama, H., & Qasba, P.K. (1986) Proc. Natl. Acad. Sci. USA, 83, 4720–4724.
5) Weinstein, J., Lee, E.U., McEntee, K., Lai, P.H., & Paulson, J.C. (1987) J. Biol. Chem., 262, 17735–17743.
6) Kukowska-Latallo, J.F., Larsen, R.D., Nair, R.P., & Lowe, J.B. (1990) Genes Dev., 4, 1288–1303.
7) Nishikawa, A., Ihara, Y., Hatakeyama, M., Kangawa, K., & Taniguchi, N. (1992) J. Biol. Chem., 267, 18199–18204.
8) Nagata, Y., Yamashiro, S., Yodoi, J., Lloyd, K.O., Shiku, H., & Furukawa, K. (1992) J. Biol. Chem., 267, 12082–12089.
9) Haraguchi, M., Yamashiro, S., Yamamoto, A., Furukawa, K., Takamiya, K., Lloyd, K.O., Shiku, H., & Furukawa, K. (1994) Proc. Natl. Acad. Sci. USA, 91, 10455–10459.
10) Fukumoto, S., Miyazaki, H., Urano, T., Furukawa, K., & Furukawa, K. (1999) J. Biol. Chem., 274, 9271–9276.
11) Miyazaki, H., Fukumoto, S., Okada, M., Hasegawa, T., Furukawa, K., & Furukawa, K. (1997) J. Biol. Chem., 272, 24794–24799.
12) Kojima, Y., Fukumoto, S., Furukawa, K., Okajima, T., Wiels, J., Yokoyama, K., Suzuki, Y., Ohta, M., & Furukawa, K. (2000) J. Biol. Chem., 275, 15152–15156.
13) Takamiya, K., Yamamoto, A., Furukawa, K., Yamashiro, S., Shin, M., Okada, M., Fukumoto, S., Haraguchi, M., Takedam, N., Fujimura, K., Sakae, M., Kishikawa, M., Shiku, H., Furukawa, K., & Aizawa, S. (1996) Proc. Natl. Acad. Sci. USA, 93, 10662–10667.
14) Takamiya, K., Yamamoto, A., Furukawa, K., Zhao, J., Fukumoto, S., Yamashiro, S., Okada, M., Haraguchi, M., Shin, M., Kishikawa, M., Shiku, H., Aizawa, S., & Furukawa, K. (1998) Proc. Natl. Acad. Sci. USA, 95, 12147–12152.
15) Furukawa, K., Takamiya, K., Okada, M., Inoue, M., Fukumoto, S., & Furukawa, K. (2001) Biochim. Biophys. Acta, 1525, 1–12.
16) Furukawa, K., Tokuda, N., Okuda, T., Tajima, O., & Furukawa, K. (2004) Semin. Cell Dev. Biol., 15, 389–396.
17) Watanabe, T., Pukel, C.S., Takeyama, H., Lloyd, K.O., Shiku, H., Li, L.T., Travassos, L.R., Oettgen, H.F., & Old, L.J. (1982) J. Exp. Med., 156, 1884–1889.
18) Tai, T., Cahan, L.D., Paulson, J.C., Saxton, R.E., & Irie, R.F. (1984) J. Natl. Cancer Inst., 73, 627–633.
19) Dippold, W.G., Lloyd, K.O., Li, L.T., Ikeda, H., Oettgen, H.F., & Old, L.J. (1980) Proc. Natl. Acad. Sci. USA, 77, 6114–6118.
20) Pukel, C.S., Lloyd, K.O., Travassos, L.R., Dippold, W.G., Oettgen, H.F., & Old, L.J. (1982) J. Exp. Med., 155, 1133–1147.
21) Saarinen, U.M., Coccia, P.F., Gerson, S.L., Pelley, R., & Cheung, N.K. (1985) Cancer Res., 145, 5969–5975.
22) Natoli, E.J. Jr., Livingston, P.O., Pukel, C.S., Lloyd, K.O., Wiegandt, H., Szalay, J., Oettgen, H.F., & Old, L.J. (1986) Cancer Res., 46, 4116–4120.
23) Portoukalian, J., Zwingelstein, G., & Doré, J.F. (1979) Eur. J. Biochem., 94, 19–23.
24) Calbia, J.M., Yu, R.K., Macaela, L.J., Kirkwood, J.M., & Varga, J.M. (1984) Biochem. Biophys. Res. Commun., 720, 500–504.
25) Yamaguchi, H., Furukawa, K., Fortunato, S.R., Livingston, P.O., Lloyd, K.O., Oettgen, H.F., & Old, L.J. (1987) Proc. Natl. Acad. Sci. USA, 84, 2416–2420.
26) Furukawa, K., Yamaguchi, H., Oettgen, H.F., Old, L.J., & Lloyd, K.O. (1988) J. Biol. Chem., 263, 18507–18512.
27) Yamaguchi, H., Furukawa, K., Fortunato, S.R., Livingston, P.O., Lloyd, K.O., Oettgen, H.F., & Old, L.J. (1990) Proc. Natl. Acad. Sci. USA, 87, 3333–3337.
28) Kobayashi, T., Yokoyama, I., Suzuki, A., Abe, M., Hayashi, S., Matsuda, H., Morozumi, K., Breimer, M.E., Rydberg, L., Groth, C.G., Tibell, A., Korsgren, O., Takagi, H., & Nakao, A. (2000) Xenotransplantation, 7, 177–180.
29) Furukawa, K., Thampoe, I.J., Yamaguchi, H., & Lloyd, K.O. (1989) J. Immunol., 142, 848–854.
30) Kawano, T., Koyama, S., Takematsu, H., Kozutsumi, Y., Kawasaki, H., Kawashima, S., Kawasaki, T., & Suzuki, A. (1995) J. Biol. Chem., 270, 16458–16463.
31) Hakomori, S. & Handa, K. (2002) FEBS Lett., 531, 88–92.
32) Aksoy, N. & Akinci, O.F. (2004) Macromol. Biosci., 4, 483–496.
33) Brockhausen, I. (1999) Biochim. Biophys. Acta, 1473, 67–95.
34) Dall’Olio, F., Malagolini, N., Trinchera, M., & Chiricolo, M. (2012) Front. Biosci., 17, 670–699.
35) Durrant, L.G., Noble, P., & Spendlove, I. (2012) Clin. Exp. Immunol., 167, 206–215.
36) Old, L.J. (1981) Cancer Res., 41, 361–375.
37) Merritt, W.D., Casper, J.T., Lauer, S.J., & Reaman, G.H. (1987) Cancer Res., 47, 1724–1730.
38) Siddiqui, B., Buehler, J., DeGregorio, M.W., & Macher, B.A. (1984) Cancer Res., 44, 5262–5265.
39) Furukawa, K., Akagi, T., Nagata, Y., Yamada, Y., Shimotohno, K., Cheung, N.K., Shiku, H., & Furukawa, K. (1993) Proc. Natl. Acad. Sci. USA, 90, 1972–1976.
40) Saito, M., Yu, R.K., & Cheung, N.K. (1985) Biochem. Biophys. Res. Commun., 127, 1–7.
41) Heiner, J.P., Miraldi, F., Kallick, S., Makley, J., Neely, J., Smith-Mensah, W.H., & Cheung, N.K. (1987) Cancer Res., 47, 5377–5381.
42) Yoshida, S., Fukumoto, S., Kawaguchi, H., Sato, S., Ueda, R., & Furukawa, K. (2001) Cancer Res., 61, 4244–4252.
43) Cheresh, D.A., Rosenberg, J., Mujoo, K., Hirschowitz, L., & Reisfeld, R.A. (1986) Cancer Res., 46, 5112–5118.
44) Shibuya, H., Hamamura, K., Hotta, H., Matsumoto, Y., Nishida, Y., Hattori, H., Furukawa, K., Ueda, M., & Furukawa, K. (2012) Cancer Sci., 103, 1656–1664.
45) Cazet, A., Lefebvre, J., Adriaenssens, E., Julien, S., Bobowski, M., Grigoriadis, A., Tutt, A., Tulasne, D., Le Bourhis, X., & Delannoy, P. (2010) Mol. Cancer Res., 8, 1526–1535.
46) Thurin, J., Thurin, M., Herlyn, M., Elder, D.E., Steplewski, Z., Clark, W.H. Jr., & Koprowski, H. (1986) FEBS Lett., 208, 17–22.
47) Furukawa, K., Ohkawa, Y., Yamauchi, Y., Hamamura, K., Ohmi, Y., & Furukawa, K. (2011) J. Biochem., 151, 573–578.
48) Hakomori, S., Yamamura, S., & Handa, A.K. (1998) Ann. N. Y. Acad. Sci., 845, 1–10.
49) Vaudry, D., Stork, P.J., Lazarovici, P., & Eiden, L.E. (2002) Science, 296, 1648–1649.
50) Greene, L.A. & Tischler, A.S. (1976) Proc. Natl. Acad. Sci. USA, 73, 2424–2428.
51) Ferrari, G., Anderson, B.L., Stephens, R.M., Kaplan, D.R., & Greene, L.A. (1995) J. Biol. Chem., 270, 3074–3080.
52) Mutoh, T., Tokuda, A., Miyadai, T., Hamaguchi, M., & Fujiki, N. (1995) Proc. Natl. Acad. Sci. USA, 92, 5087–5091.
53) Nishio, M., Fukumoto, S., Furukawa, K., Ichimura, A., Miyazaki, H., Kusunoki, S., Urano, T., & Furukawa, K. (2004) J. Biol. Chem., 279, 33368–33378.
54) Fukumoto, S., Mutoh, T., Hasegawa, T., Miyazaki, H., Okada, M., Goto, G., Furukawa, K., Urano, T., & Furukawa, K. (2000) J. Biol. Chem., 275, 5832–5838.
55) Yanagisawa, M., Taga, T., Nakamura, K., Ariga, T., & Yu, R.K. (2005) J. Neurochem., 95, 1311–1320.
56) Lloyd, K.O. & Old, L.J. (1989) Cancer Res., 49, 3445–3451.
57) Ravindranath, M.H., Tsuchida, T., Morton, D.L., Irie, R.F., & Rabindranas, G.G. (1999) Cancer, 67, 3029–3035.
58) Furukawa, K. & Lloyd, K.O. (1990) Human Melanoma: From Basic Research to Clinical Application (Ferrone, S., ed.), pp. 15–30, Springer, Heidelberg.
59) Daniotti, J.L., Vilcaes, A.A., Torres Demichelis, V., Ruggiero, F.M., & Rodriguez-Walker, M. (2013) Front Oncol., 3, 306.
60) Hamamura, K., Furukawa, K., Hayashi, T., Hattori, T., Nakano, J., Nakashima, H., Okuda, T., Mizutani, H., Hattori, H., Ueda, M., Urano, T., Lloyd, K.O., & Furukawa, K. (2005) Proc. Natl. Acad. Sci. USA, 102, 11041–11046.
61) Hamamura, K., Tsuji, M., Ohkawa, Y., Nakashima, H., Miyazaki, S., Urano, T., Yamamoto, N., Ueda, M., Furukawa, K., & Furukawa, K. (2008) Biochim. Biophys. Acta, 1780, 513–519.
62) Hamamura, K., Tsuji, M., Hotta, H., Ohkawa, Y., Takahashi, M., Shibuya, H., Nakashima, H., Yamauchi, Y., Hashimoto, N., Hattori, H., Ueda, M., Furukawa, K., & Furukawa, K. (2011) J. Biol. Chem., 286, 18526–18537.
63) Furukawa, K., Hamamura, K., Aixinjueluo, W., & Furukawa, K. (2006) Ann. N. Y. Acad. Sci., 1086, 185–198.
64) Furukawa, K., Hamamura, K., Nakashima, H., & Furukawa, K. (2008) Proteomics, 8, 3312–3316.
65) Ohkawa, Y., Miyazaki, S., Miyata, M., Hamamura, K., Furukawa, K., & Furukawa, K. (2008) Biochem. Biophys. Res. Commun., 373, 14–19.
66) Ohkawa, Y., Miyazaki, S., Hamamura, K., Kambe, M., Miyata, M., Tajima, O., Ohmi, Y., Yamauchi, Y., Furukawa, K., & Furukawa, K. (2010) J. Biol. Chem., 285, 27213–27223.
67) Furukawa, K., Kambe, M., Miyata, M., Ohkawa, Y., Tajima, O., & Furukawa, K. (2014) Cancer Sci., 105, 52–63.
68) Hanibuchi, M., Yano, S., Nishioka, Y., Yanagawa, H., & Sone, S. (1996) Jpn. J. Cancer Res., 87, 497–504.
69) Hanibuchi, M., Yano, S., Nishioka, Y., Yanagawa, H., & Sone, S. (1996) Jpn. J. Cancer Res., 87, 497–504.
70) Aixinjueluo, W., Furukawa, K., Zhang, Q., Hamamura, K., Tokuda, N., Yoshida, S., Ueda, R., & Furukawa, K. (2005) J. Biol. Chem., 280, 29828–29836.
71) Yoshida, S., Kawaguchi, H., Sato, S., Ueda, R., & Furukawa, K. (2002) Jpn. J. Cancer Res., 93, 816–824.
72) Sarkar, T.R., Battula, V.L., Werden, S.J., Vijay, G.V., Ramirez-Peña, E.Q., Taube, J.H., Chang, J.T., Miura, N., Porter, W., Sphyris, N., Andreeff, M., & Mani, S.A. (2015) Oncogene, 34, 2958–2967.
73) Battula, V.L., Shi, Y., Evans, K.W., Wang, R.Y., Spaeth, E.L., Jacamo, R.O., Guerra, R., Sahin, A.A., Marini, F.C., Hortobagyi, G., Mani, S.A., & Andreeff, M. (2012) J. Clin. Invest., 122, 2066–2078.
74) Furukawa, K., Hamamura, K., Ohkawa, Y., Ohmi, Y., & Furukawa, K. (2012) Glycoconj. J., 29, 579–584.
75) Fukuda, M., Horibe, K., & Furukawa, K. (1998) Int. J. Mol. Med., 2, 471–475.
76) Matthay, K.K., George, R.E., & Yu, A.L. (2012) Clin. Cancer Res., 18, 2740–2753.
77) Raffaghello, L., Marimpietri, D., Pagnan, G., Pastorino, F., Cosimo, E., Brignole, C., Ponzoni, M., & Montaldo, P.G. (2003) Cancer Lett., 197, 205–209.
78) Parsons, K., Bernhardt, B., & Strickland, B. (2013) Ann. Pharmacother., 47, 210–218.
79) Mitsuda, T., Furukawa, K., Fukumoto, S., Miyazaki, H., Urano, T., & Furukawa, K. (2002) J. Biol. Chem., 277, 11239–11246.
80) Dong, Y., Ikeda, K., Hamamura, K., Zhang, Q., Kondo, Y., Matsumoto, Y., Ohmi, Y., Yamauchi, Y., Furukawa, K., Taguchi, R., & Furukawa, K. (2010) Cancer Sci., 101, 2039–2047.
81) Nakashima, H., Hamamura, K., Houjou, T., Taguchi, R., Yamamoto, N., Mitsudo, K., Tohnai, I., Ueda, M., Urano, T., Furukawa, K., & Furukawa, K. (2007) Cancer Sci., 98, 512–520.
82) Yilmaz, Y.E., Lawless, J.F., Andrulis, I.L., & Bull, S.B. (2013) J. Clin. Oncol., 31, 2047–2054.
83) Wang, J., Chen, J., Chen, X., Wang, B., Li, K., & Bi, J. (2011) PLoS ONE, 6, e28844.
84) Meng, X., Zhong, J., Liu, S., Murray, M., & Gonzalez-Angulo, A.M. (2012) Cancer Metastasis Rev., 31, 247–268.
85) Takenaga, K. (1986) Cancer Metastasis Rev., 5, 67–75.
86) Chen, H.H., Fukumoto, S., Furukawa, K., Nakao, A., Akiyama, S., Urano, T., & Furukawa, K. (2003) Int. J. Cancer, 103, 169–176.
87) Zhang, Q., Furukawa, K., Chen, H.H., Sakakibara, T., Urano, T., & Furukawa, K. (2006) J. Biol. Chem., 281, 18145–18155.
88) Furukawa, K., Matsumoto, Y., Zhang, Q., & Furukawa, K. (2015) Sugar Chains—Decoding the Functions of Glycans (Suzuki, T., Ohtsubo, K., Taniguchi, N., eds.), pp. 55–70, Springer, Tokyo.
89) Matsumoto, Y., Zhang, Q., Akita, K., Nakada, H., Hamamura, K., Tokuda, N., Tsuchida, A., Matsubara, T., Hori, T., Okajima, T., Furukawa, K., Urano, T., & Furukawa, K. (2012) Biochem. Biophys. Res. Commun., 419, 7–13.
90) Zhang, Y., Iwasaki, H., Wang, H., Kudo, T., Kalka, T.B., Hennet, T., Kubota, T., Cheng, L., Inaba, N., Gotoh, M., Togayachi, A., Guo, J., Hisatomi, H., Nakajima, K., Nishihara, S., Nakamura, M., Marth, J.D., & Narimatsu, H. (2003) J. Biol. Chem., 278, 573–584.
91) Brooks, S.A., Carter, T.M., Bennett, E.P., Clausen, H., & Mandel, U. (2007) Acta Histochem., 109, 273–284.
92) Ju, T., Otto, V.I., & Cummings, R.D. (2011) Angew. Chem. Int. Ed. Engl., 50, 1770–1791.
93) Ju, T., Wang, Y., Aryal, R.P., Lehoux, S.D., Ding, X., Kudelka, M.R., Cutler, C., Zeng, J., Wang, J., Sun, X., Heimburg-Molinaro, J., Smith, D.F., & Cummings, R.D. (2013) Proteomics Clin. Appl., 7, 618–631.
94) Matsumoto-Takasaki, A., Hanashima, S., Aoki, A., Yuasa, N., Ogawa, H., Sato, R., Kawakami, H., Mizuno, M., Nakada, H., Yamaguchi, Y., & Fujita-Yamaguchi, Y. (2012) J. Biochem., 151, 273–282.
95) Morita, N., Yajima, Y., Asanuma, H., Nakada, H., & Fujita-Yamaguchi, Y. (2009) Biosci. Trends., 3, 32–37.
96) Matsumoto, Y., Zhang, Q., Akita, K., Nakada, H., Hamamura, K., Tsuchida, A., Okajima, T., Furukawa, K., Urano, T., & Furukawa, K. (2013) J. Biol. Chem., 288, 24264–24276.
97) Margadant, C., Monsuur, H.N., Norman, J.C., & Sonnenberg, A. (2011) Curr. Opin. Cell Biol., 23, 607–614.
98) Cabodi, S., del Pilar Camacho-Leal, M., Di Stefano, P., & Defilippi, P. (2010) Nat. Rev. Cancer, 10, 858–870.
99) Tringali, C., Lupo, B., Silvestri, I., Papini, N., Anastasia, L., Tettamanti, G., & Venerando, B. (2012) J. Biol. Chem., 287, 42835–42845.
100) Todeschini, A.R., Dos Santos, J.N., Handa, K., & Hakomori, S.I. (2007) J. Biol. Chem., 282, 8123–8133.
101) Berois, N., Blanc, E., Ripoche, H., Mergui, X., Trajtenberg, F., Cantais, S., Barrois, M., Dessen, P., Kågedal, B., Bénard, J., Osinaga, E., & Raguénez, G. (2006) Clin. Chem., 52, 1701–1712.
102) Schengrund, C.L. (1990) Brain Res. Bull., 24, 131–141.
103) Inoue, M., Fujii, Y., Furukawa, K., Okada, M., Okumura, K., Hayakawa, T., Furukawa, K., & Sugiura, Y. (2002) J. Biol. Chem., 277, 29881–29888.
104) Kawai, H., Allende, M.L., Wada, R., Kono, M., Sango, K., Deng, C., Miyakawa, T., Crawley, J.N., Werth, N., Bierfreund, U., Sandhoff, K., & Proia, R.L. (2001) J. Biol. Chem., 276, 6885–6888.
105) Ohmi, Y., Tajima, O., Ohkawa, Y., Mori, A., Sugiura, Y., Furukawa, K., & Furukawa, K. (2009) Proc. Natl. Acad. Sci. USA, 106, 22405–22410.
106) Ohmi, Y., Tajima, O., Ohkawa, Y., Yamauchi, Y., Sugiura, Y., Furukawa, K., & Furukawa, K. (2011) J. Neurochem., 116, 926–935.
107) Ohmi, Y., Ohkawa, Y., Yamauchi, Y., Tajima, O., Furukawa, K., & Furukawa, K. (2012) Neurochem. Res., 37, 1185–1191.
108) Furukawa, K., Ohmi, Y., Ohkawa, Y., Tokuda, N., Kondo, Y., Tajima, O., & Furukawa, K. (2011) Neurochem. Res., 36, 1578–1586.
109) Rogers, J., Cooper, N.R., Webster, S., Schultz, J., McGeer, P.L., Styren, S.D., Civin, W.H., Brachova, L., Bradt, B., Ward, P., & Lieberburg, I. (1992) Proc. Natl. Acad. Sci. USA, 89, 10016–10020.
110) Shen, Y., Lue, L., Yang, L., Roher, A., Kuo, Y., Strohmeyer, R., Goux, W.J., Lee, V., Johnson, G.V., Webster, S.D., Cooper, N.R., Bradt, B., & Rogers, J. (2001) Neurosci. Lett., 305, 165–168.
111) Sardi, F., Fassina, L., Venturini, L., Inguscio, M., Guerriero, F., Rolfo, E., & Ricevuti, G. (2011) Autoimmun. Rev., 11, 149–153.
112) Shen, Y. & Meri, S. (2003) Prog. Neurobiol., 70, 463–472.
113) Delrieu, J., Ousset, P.J., Caillaud, C., & Vellas, B. (2012) J. Neurochem., 120(Suppl 1), 186–193.
114) Shah, S. & Federoff, H.J. (2011) Immunotherapy, 3, 287–298.
115) Patra, S.K. (2008) Biochim. Biophys. Acta, 1785, 182–206.
116) Simons, K. & Gerl, M.J. (2010) Nat. Rev. Mol. Cell Biol., 11, 688–699.
117) Furukawa, K., Tajima, O., Okuda, T., Tokuda, N., & Furukawa, K. (2007) Comprehensive Glycoscience from Chemistry to Systems Biology (Kamerling, J.P., Boons, G.J., Lee, Y.C., Suzuki, A., Taniguchi, N., & Voragen, A.G.J., eds.), pp. 149–157, Elsevier, Oxford, UK.
118) Yamashita, T., Hashiramoto, A., Haluzik, M., Mizukami, H., Beck, S., Norton, A., Kono, M., Tsuji, S., Daniotti, J.L., Werth, N., Sandhoff, R., Sandhoff, K., & Proia, R.L. (2003) Proc. Natl. Acad. Sci. USA, 100, 3445–3449.
119) Furukawa, K., Ohmi, Y., Ohkawa, Y., Tajima, O., & Furukawa, K. (2014) Adv. Neurobiol., 9, 307–320.
120) Simons, K. & Ikonen, E. (1997) Nature, 387, 569–572.
121) Hashimoto, N., Hamamura, K., Kotani, N., Furukawa, K., Kaneko, K., Honke, K., & Furukawa, K. (2012) Proteomics, 12, 3154–3163.
122) Simons, K. & Ikonen, E. (1997) Nature, 387, 569–572.
123) Suzuki, K.G., Kasai, R.S., Fujiwara, T.K., & Kusumi, A. (2013) Methods Cell Biol., 117, 373–390.
124) Suzuki, K.G., Kasai, R.S., Hirosawa, K.M., Nemoto, Y.L., Ishibashi, M., Miwa, Y., Fujiwara, T.K., & Kusumi, A. (2012) Nat. Chem. Biol., 8, 774–783.
125) Komura, N. Suzuki, K.G.N., Ando, H., Konishi, M., Koikeda, M., Imamura, A., Chadda, R., Fujiwara, T.K., Tsuboi, H., Sheng, R., Cho, W., Furukawa, K., Furukawa, K., Yamauchi, Y., Ishida, H., Kusumi, A., & Kiso, M. (2016). Nat. Chem. Biol., in press.
126) Miyata, M., Ichihara, M., Tajima, O., Sobue, S., Kambe, M., Sugiura, K., Furukawa, K., & Furukawa, K. (2014) Biochem. Biophys. Res. Commun., 445, 504–510.
127) Peinado, H., Alečković, M., Lavotshkin, S., Matei, I., Costa-Silva, B., Moreno-Bueno, G., Hergueta-Redondo, M., Williams, C., García-Santos, G., Ghajar, C., Nitadori-Hoshino, A., Hoffman, C., Badal, K., Garcia, B.A., Callahan, M.K., Yuan, J., Martins, V.R., Skog, J., Kaplan, R.N., Brady, M.S., Wolchok, J.D., Chapman, P.B., Kang, Y., Bromberg, J., & Lyden, D. (2012) Nat. Med., 18, 883–891.
128) Ilhamjan, S., Hashimoto, N., Matsumoto, Y., Yamaji, T., Furukawa, K., & Furukawa, K. (2013) J. Biol. Chem., 288, 35417–35427.
129) Kondo, Y., Tokuda, N., Nishitani, C., Ohto, U., Akashi-Takamura, S., Ito, Y., Uchikawa, M., Kuroki, Y., Miyake, K., Zhang, Q., Furukawa, K., & Furukawa, K. (2013) Proc. Natl. Acad. Sci. USA, 110, 4714–4719.
130) Simpson, M.A., Cross, H., Proukakis, C., Priestman, D.A., Neville, D.C., Reinkensmeier, G., Wang, H., Wiznitzer, M., Gurtz, K., Verganelaki, A., Pryde, A., Patton, M.A., Dwek, R.A., Butters, T.D., Platt, F.M., & Crosby, A.H. (2004) Nat. Genet., 36, 1225–1229.