抗菌薬開発が一段落し「ポスト抗菌薬時代(post-antibiotic era)」に入ったと言われるが,薬剤耐性菌が増加し続け,その蔓延が感染症治療における深刻な課題となっている.2014年WHO総会においてAntimicrobial Resistance(AMR)決議が採択され,抗菌薬の適正使用,感染制御の強化等が加盟国に求められている.2015年オバマ米国大統領は,米国内年間2万人以上の死亡原因となっている薬剤耐性菌対策のために国家行動計画を発表し,その後も国際政治の場(G7/G8サミット等)でAMR問題が議題としてあげられている.また,米国疾病対策センター(CDC)は,過剰な抗菌薬使用が薬剤耐性菌の出現と蔓延の主たる原因と指摘し,AMR問題を克服する総合的アクションを提起している.耐性菌をめぐるこのような世界情勢のなか,本稿では,薬剤耐性菌起因菌のトップ3に入るメチシリン耐性黄色ブドウ球菌(methicillin-resistant Staphylococcus aureus: MRSA)の薬剤耐性化メカニズムを中心に最近の知見を紹介する.
黄色ブドウ球菌は,ヒトの常在菌でありながら,強毒菌に分類される病原微生物で,抗生物質に耐性となる能力がきわめてすぐれており,ペニシリンやセフェム等ほとんどすべてのβラクタム系抗菌薬が効かなくなるMRSA感染症は人類の脅威である.1961年にイギリスでMRSAが報告されて以来,半世紀にわたり世界に蔓延し,現在は難治性感染症を起こす院内感染の起因菌として,世界中の医療施設で大きな問題になっている.わが国の医療施設の場合,血液培養で分離された黄色ブドウ球菌のうち,約30~60%がMRSAに該当する1).近年,院外の健常成人からもMRSAが分離され,これらを医療施設型MRSA(hospital-associated MRSA:HA-MRSA)と区別して,市中感染型MRSA(community-acquired MRSA:CA-MRSA)と呼んでいる2).CA-MRSAはHA-MRSAと比較して,βラクタム系薬剤以外に対する薬剤耐性遺伝子を多く持たないため,他の薬剤に対しては感受性を示すことが多いが,白血球溶解毒素(Panton-Valentine leucocidin:PVL)などの病原因子を保有する強毒株がMRSA治療歴のない健常者から高頻度に分離される.また,CA-MRSAは高い死亡率の報告と若い患者で発症する傾向があるので注意が必要である3).最近では,家畜由来の薬剤耐性遺伝子を含む染色体カセットSCCmec(staphylococcal cassette chromosome mec,後述)type XIを持つLA-MRSA(live-stock associated MRSA)が北欧で蔓延しており,将来,家畜から人へ伝播される可能性も考えられる.
1996年には,MRSA感染症の第一選択薬であるバンコマイシンが無効の患者が世界で初めてわが国で現れ,感染部位からバンコマイシン中等度耐性黄色ブドウ球菌(vancomycin-intermediate S. aureus: VISA)Mu50株が分離され4),それ以来各国でVISAが分離されるようになった.しかし,バンコマイシンの奏功しない症例の多くからVISAが検出されないこと,また治療後にMRSA感染症が再燃することなどの課題がある.そこで我々は,このような問題を克服するためにバンコマイシン耐性化機構について検討したところ,新規表現型の薬剤耐性菌slow-VISAを見いだした.以下に,これらMRSAのβラクタム系薬剤およびバンコマイシンの耐性化機構に焦点を当て,MRSA感染症の再燃の仕組みについて述べる.
MRSAの疫学と薬剤の使用開始および耐性菌の出現の年代をもとに黄色ブドウ球菌の変遷を時系列に調べたときに四つの大きな波(wave)がみられる5).
- Wave 1:1940年代にペニシリンが導入されて以来,この薬剤を分解するペニシリナーゼとPVLを産生するファージtype 80/81の薬剤耐性菌が蔓延.
- Wave 2:ペニシリナーゼ耐性のメチシリンが導入されてからMRSAが出現し,薬剤耐性遺伝子カセットSCCmec type Iを持つMRSA-Iが1970年代初頭まで蔓延.
- Wave 3:1970年代半ばから,HA-MRSAであるSCCmec type IIを持つMRSA-IIとSCCmec typeIIIを持つMRSA-IIIが蔓延,その後1996年にバンコマイシンに対し中等度耐性のVISAが出現した.
- Wave 4:CA-MRSAのSCCmec typeIVを持つMRSA-IVが出現し,2002年には,バンコマイシン耐性遺伝子(van)を持つ耐性黄色ブドウ球菌(VRSA)が発見された.
このように黄色ブドウ球菌は,メチシリンなどのβラクタム系抗菌薬に対する多剤耐性を獲得したMRSAとなり,さらに第一選択薬であるバンコマイシンに対する耐性をも獲得しVISAまたはVRSAへと変わりつつあり,感染症治療の負担が増大していると考えられる.
βラクタム系薬剤は,細菌細胞壁ペプチドグリカンの合成に関わる酵素を阻害することにより抗菌作用を示すが,MRSAは以下の二つの耐性化機構をもっている.
- (i)ペニシリン系薬剤に対する耐性は,耐性菌が産生するペニシリナーゼ(blaZ遺伝子によりコードされている)と呼ばれる酵素により,基質のペニシリン系薬剤が不活性化(加水分解)される.
- (ii)MRSAは,本来の黄色ブドウ球菌に存在するペニシリン結合タンパク質PBP2(penicillin-binding protein 2)の変異型酵素であるPBP2′を有する.PBP2は,ペプチドグリカンの糖鎖伸長反応に関わるトランスグリコシラーゼ活性や架橋反応に関わるトランスペプチダーゼ活性を持つが,これらはβラクタム系薬剤により阻害される.しかし,変異型PBP2′は狭域半合成ペニシリンやセフェム系薬剤に対する親和性が低く,これら薬剤の存在下でも細胞壁合成が可能であり,生育することができるため耐性化が起こる.このPBP2′をコードする遺伝子がmecAである6).
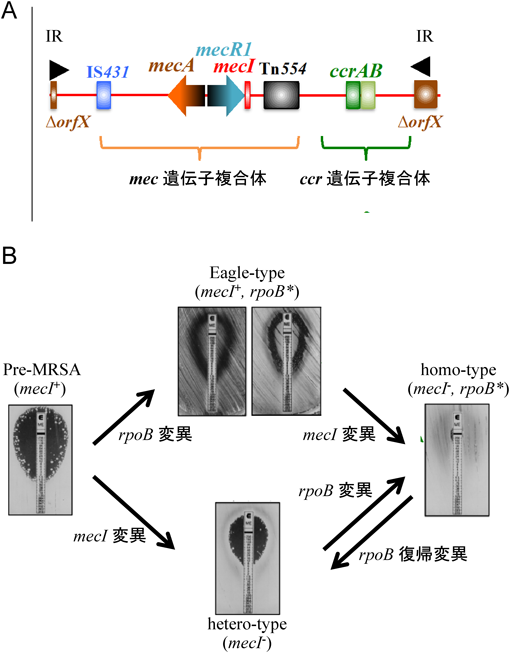
mecAは,外来性の遺伝子カセットSCCmecと呼ばれる特徴的なゲノムアイランド上に存在する.このSCCmecが,メチシリン感受性黄色ブドウ球菌(methicillin-susceptible S. aureus: MSSA)の菌体内に入り,染色体DNAに挿入されMRSAが構築される7, 8).図1AにSCCmecの構造を示す9).カセットの両端には逆位反復配列(inverted repeats:IR)があり,部位特異的組換え酵素(cassette chromosome recombinase:ccr)遺伝子複合体(ccr gene complex)および挿入配列IS431, mecA遺伝子とその制御遺伝子(mecRおよびmecI)で構成されるmec遺伝子複合体(mec gene complex)などからなる.SCCmecは,複数あるccr遺伝子複合体のクラスとmec遺伝子複合体のタイプの組合わせにより,現在type I~XIに分類されており,これらSCCmecの多型性を利用したMRSAの院内や市中のアウトブレイクを調査する方法は世界各国で汎用されている(http://www.staphylococcus.net/indexJP.html).
薬剤に対して高度耐性のMRSAが出現する過程には二つの経路が考えられている(図1B).初期に出現したMRSAの多くは,βラクタム系薬剤に対する耐性度は高くなく,イミペネムなどのカルバペネム系抗菌薬が有効であり,不均一な細胞集団で構成されるhetero-MRSAであった.hetero-MRSAは,mecAの制御遺伝子であるmecIが変異しており(mecI−),βラクタム系薬剤に暴露されるとhomo-MRSAへと高度耐性化が進む.高度耐性になるためには,mecA遺伝子に加えて染色体上の他の変異(chr*)の必要性が指摘されており,細胞壁多糖であるタイコ酸合成に関連する遺伝子llmや自己溶解(ペプチドグリカン分解)に関連する遺伝子lytHの変異,また筆者らが報告した2成分制御機構vraSRの変異等がある10).最近では,相羽らによりRNAポリメラーゼサブユニットをコードするrpoB遺伝子の変異の関与が報告された(図1B)11).もう一方の経路は,野生型のmecI遺伝子を持つが,mec以外の染色体の変異chr*を持つ中等度耐性のEagle-type MRSAを経由するものである.いずれにしても高度耐性化が進行するためには,mecAの獲得,mecIの変異,rpoBの変異など他の染色体遺伝子の変異などのステップが必要となる.このように,ブドウ球菌は,優れた生存戦略を持つ菌として進化し続けている.
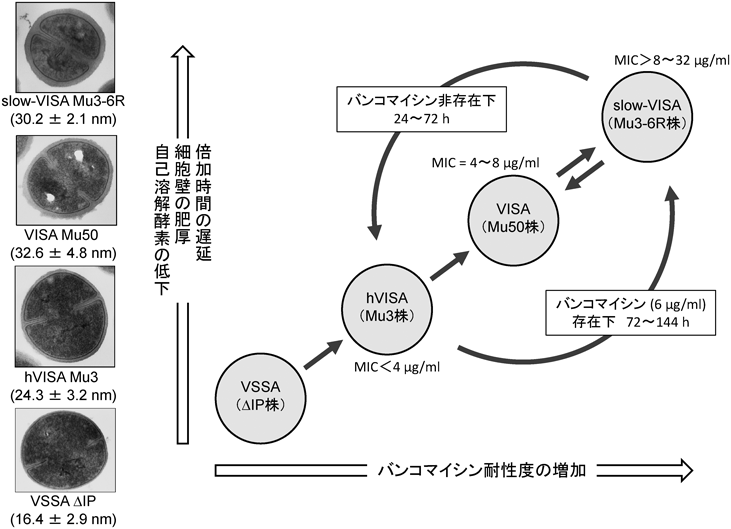
米国,韓国,ブラジル,欧州などの世界各地の医療機関から,バンコマイシンに中等度耐性,すなわち最小生育阻止濃度(minimum inhibitory concentration:MIC)が4~8 µg/mL程度のVISAが続々と報告されている.これらのVISAは,共通して厚い細胞壁を持ち,バンコマイシンが細胞壁を通過する過程で,それをトラップし,本来の結合作用部位である細胞壁の構成成分の合成系に到達できなくするという新規の耐性メカニズムを持っている(trapping and clogging mechanism)12).
VISAに加えて問題になっているのは,heteo-VISA(heterogeneous VISA:hVISA)の存在である.hVISAは,MICVCM<4 µg/mLであり,VISAの耐性基準値未満を示すので,バンコマイシン感受性黄色ブドウ球菌(vancomycin-susceptible SA:VSSA)に分類される.しかし,1×10−6以上の頻度でMICVCM≧4 µg/mLの耐性菌が出現する細胞集団であるため,VSSAとは区別して分類している4).hVISAは,VSSAからVISAへの耐性化段階における中間に位置し(図2),耐性獲得の初期段階に関与すると考えられている.
実際にin vitro条件下でVSSAをバンコマイシンまたはイミペネムに曝露すると,高頻度にhVISAが出現した10).このことから,バンコマイシンやイミペネムによる治療を継続するとhVISAが出現し,VISAの場合と同様に治療困難になる危険性が示唆されるので,臨床現場ではMICVCMの測定に加えて,hVISAの検出検査が必要であると考えられている.最近,筆者らは国内の臨床分離VSSA(MRSA)N315株の染色体上に,VISA Mu50株に特有に見いだされた変異遺伝子を導入し,VSSAからhVISAを経由してVISAを再構築し段階的にバンコマイシン耐性化が生じることをin vitro条件下で証明した(図2)13).
2002年には,米国ミシガン州とペンシルバニア州の2施設でMICVCM=32 µg/mLを示すバンコマイシン高度耐性黄色ブドウ球菌(vancomycin-resistant S. aureus: VRSA)が相次いで分離された14).驚くことに,これらの菌は,バンコマイシン耐性腸球菌(vancomycin-resistant Enterococci:VRE)のバンコマイシン耐性遺伝子vanAを保持しており,VREのバンコマイシン耐性をコードするトランスポゾン(Tn1546など)が,腸球菌から黄色ブドウ球菌に接合伝達されたものと考えられた.黄色ブドウ球菌間においても,このような伝播が報告されているので,近い将来,菌種間における耐性遺伝子の伝播が懸念される.
5. 新規表現型slow-VISAによるMRSA感染症再燃の仕組み
バンコマイシンまたはカルバペネム存在下で染色体上の変異が生じ,VSSAからhVISAを経由してVISAが段階的に生じることが考えられたが,筆者らはhVISAをバンコマイシン存在下で72時間以上培養すると,高いMIC値(MIC≧8 µg/mL)を示す新規表現型のslow-VISAが出現することを見いだした15, 16).slow-VISAの特徴として倍加時間の遅延のほか,VISA特有の細胞壁の肥厚がみられ,VISA以上に自己溶解酵素の低下が観察された.また,slow-VISAをバンコマイシン非存在下で24~72時間培養すると,耐性度が低下かつ安定化し,ほとんどのslow-VISAがhVISAに戻ってしまう現象も明らかになった.これらの観察結果より,バンコマイシンの奏功しない患者からVISAがほとんど検出されなかった理由は,(i)分離培養を繰り返している間に耐性度が落ちてしまったため,あるいは(ii)MIC値を測定する際,CLSI(Clinical and Laboratory Standards Institute, http://clsi.org)のガイドラインで指定された判定方法では培養時間が48時間と短いため,slow-VISAが検出されなかったことが考えられた.
バンコマイシン存在下で生じたslow-VISAは,バンコマイシン非存在下では一夜培養でその耐性度が低下してhVISAの母集団に変換される.しかし,hVISA復帰変異株のなかに少数のslow-VISAが生き残っているため,再度バンコマイシン存在下で培養すると,slow-VISAが母集団になり,MRSA感染症の再燃が起こるのではないかと推測された.
6. 細胞壁合成および核酸代謝関連遺伝子変異と薬剤耐性化
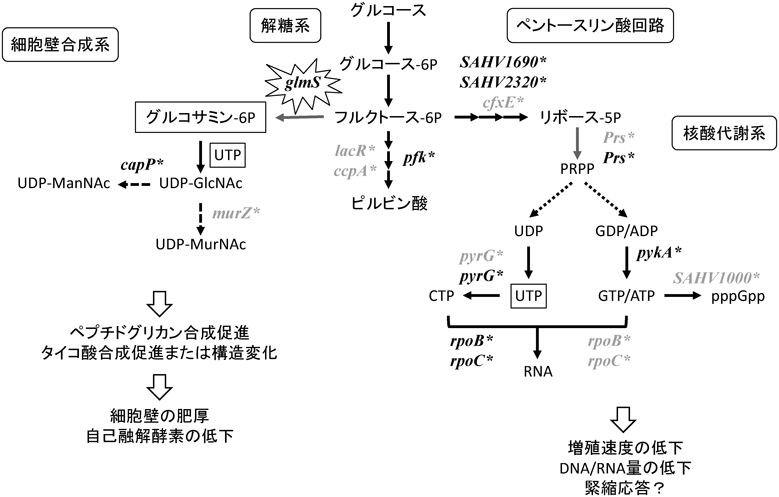
筆者らは,hVISA Mu3株をバンコマイシン(6 µg/mL)存在下in vitroで72~144時間培養して得られた26株のslow-VISAおよび薬剤非存在下でslow-VISAを培養して得られた耐性度の低下した24株のhVISAに見いだされる遺伝子の変異を調べ比較した.マイクロアレイ解析結果から,親株のhVISA Mu3に比べて,slow-VISAはglmS遺伝子の転写レベル活性が上昇していたこと,またメタボローム解析結果から,ペプチドグリカン合成の素材となるグルコサミン6-リン酸(GlcN-6P)およびUTPが3倍以上に増量していることが明らかになった.glmSは,フルクトース6-リン酸からグルコサミン6-リン酸の変換を触媒しリボスイッチの役割をする遺伝子であり(図3),黄色ブドウ球菌の細胞壁合成にきわめて重要な酵素である17).GlcN-6Pは,黄色ブドウ球菌の細胞壁の主要成分であるペプチドグリカンや壁タイコ酸(wall-teichoic acid:WTA)の合成原料となることから,slow-VISAは,これらの変異により代謝経路の流れを変え,細胞壁合成経路を活性化させ,そして細胞壁の肥厚を起こしバンコマイシン耐性を獲得したことが示唆された.
このほか,slow-VISAとその復帰変異hVISAで見いだされた主な遺伝子変異を図3の代謝経路図に示したが,核酸合成の前駆物質となるホスホリボシルピロリン酸(PRPP)の合成に関わるペントースリン酸経路やプリン/ピリミジン代謝経路の変異が広範に認められた.また一塩基多型(SNPs)解析から,MRSAの項でも述べたRNAポリメラーゼ遺伝子のrpoB, rpoCなどの変異が高頻度にみられ,核酸代謝が大きく変化していることが推察された.これらのさまざまな遺伝子の発現機構には緊縮応答やパーシスタンス現象の可能性がみられ,現在検討している.
臨床面では,国内18医療施設の血液由来臨床分離MRSA株からslow-VISAの検出を行ったところ,全体の5.6%の頻度でslow-VISAが検出された.そしてこれらslow-VISAの患者の臨床背景を調査した結果,菌血症による予後不良の死亡症例と高い相関性を示すことが明らかになった(p<0.005,筆者および畦地ら,未発表データ)ことから今後,MRSAに対する治療や感染対策を再考していく必要がある.
ブドウ球菌の病原性は固定したものではなく,絶えず外界から病原遺伝子を獲得し,よりしたたかな病原菌として進化している.一方,ブドウ球菌の薬剤耐性化はMRSAに代表されるように,化学療法剤の開発を凌駕する勢いで進んでいる.バンコマイシンが奏功しない患者が増えたものの,感染部位からはほとんどVISAが検出されず,混迷した状況が続いていたが,slow-VISAの発見により,その謎が解けつつある.また筆者らの研究によりrpoB遺伝子がリファンピシン以外の薬剤耐性化にも関与していることが明らかにされた.現在筆者らはslow-VISAの迅速な検出法の開発に挑み,slow-VISAや薬剤耐性菌による菌血症患者の早期診断に注力している.人類と共生するブドウ球菌という微生物を深く理解し,その感染を制御することは,細菌学,感染症学,化学療法学,生化学など,関連の学問分野を横断する壮大なテーマであると考えられる.今後,MRSA感染症の再燃とバンコマイシン耐性化機構をさらに詳細に解析し,よりすぐれた予防法,診断法,抗菌化学療法等の開発に役立てたい.
謝辞Acknowledgments
本研究の一部はJSPS科学研究補助金24791029, 15K09581およびS1201013の助成を受けたものです.筆者が順天堂大学大学院時代より一からご指導・ご鞭撻を賜りました故伊藤輝代先生(2014年9月ご逝去)に深く感謝するとともに,ご冥福をお祈り申し上げます.また,多くのご支援をいただきました順天堂大学医学部微生物学講座元教授の平松啓一先生,同講座助教関根美和先生,助手菱沼知美さん,当時大学院生博士課程の相羽由詞さん,同大学附属順天堂医院薬剤部畦地拓哉先生,卒業後の筆者が3年間のご指導賜りましたUniversity of California SanFrancisco校のHenry F. Chambers教授,臨床分離MRSA株分与のご支援をいただきました北里大学感染制御学講座花木秀明教授,福岡大学医学部腫瘍血液感染症内科高田徹教授および福岡大学医学部附属筑紫病院宮崎元康先生に厚く御礼申し上げます.
引用文献References
1) 院内感染対策サーベイランス(2015)http://www.nih-janis.jp/section/zen.html
2) Okuma, K., Iwakawa, K., Turnidge, J.D., Grubb, W.B., Bell, J.M., O’Brien, F.G., Coombs, G.W., Pearman, J.W., Tenover, F.C., Kapi, M., Tiensasitorn, C., Ito, T., & Hiramatsu, K. (2002) J. Clin. Microbiol., 40, 4289–4294.
3) Labandeira-Rey, M., Couzon, F., Boisset, S., Brown, E.L., Bes, M., Benito, Y., Barbu, E.M., Vazquez, V., Hook, M., Etienne, J., Vandenesch, F., & Bowden, M.G. (2007) Science, 315, 1130–1133.
4) Hiramatsu, K., Aritaka, N., Hanaki, H., Kawasaki, S., Hosoda, Y., Hori, S., Fukuchi, Y., & Kobayashi, I. (1997) Lancet, 350, 1670–1673.
5) Chambers, H.F. & Deleo, F.R. (2009) Nat. Rev. Microbiol., 7, 629–641.
6) Matsuhashi, M., Song, M.D., Ishino, F., Wachi, M., Doi, M., Inoue, M., Ubukata, K., Yamashita, N., & Konno, M. (1986) J. Bacteriol., 167, 975–980.
7) Ito, T., Katayama, Y., & Hiramatsu, K. (1999) Antimicrob. Agents Chemother., 43, 1449–1458.
8) Katayama, Y., Ito, T., & Hiramatsu, K. (2000) Antimicrob. Agents Chemother., 44, 1549–1555.
9) Katayama, Y., Ito, T., & Hiramatsu, K. (2001) Antimicrob. Agents Chemother, 45, 1955–1963.
10) Katayama, Y., Kuroda-Murakami, H., & Hiramatsu, K. (2009) Antimicrob. Agents Chemother, 53, 3190–3196.
11) Aiba, Y., Katayama, Y., Hishinuma, T., Murakami-Kuroda, H., Cui, L., & Hiramatsu, K. (2013) Antimicrob. Agents Chemother., 57, 4861–4871.
12) Cui, L., Ma, X., Sato, K., Okuma, K., Tenover, F.C., Mamizuka, E.M., Gemmell, C.G., Kim, M.N., Ploy, M.C., El-Solh, N., Ferraz, V., & Hiramatsu, K. (2003) J. Clin. Microbiol., 41, 5–14.
13) Katayama, Y., Sekine, M., Hishinuma, T., Aiba, Y., & Hiramatsu, K. (2016) Antimicrob. Agents Chemother., 60, 3730–3742.
14) Centers for Disease Control and Prevention. (2002) MMWR Morb. Mortal. Wkly. Rep., 51, 565–567.
15) Saito, M., Katayama, Y., Hishinuma, T., Iwamoto, A., Aiba, Y., Kuwahara-Arai, K., Cui, L., Matsuo, M., Aritaka, N., & Hiramatsu, K. (2014) Antimicrob. Agents Chemother., 58, 5024–5035.
16) Hiramatsu, K., Kayayama, Y., Matsuo, M., Aiba, Y., Saito, M., Hishinuma, T., & Iwamoto, A. (2014) J. Global Antimicrob. Resist., 2, 213–224.
17) Lünse, C.E., Schmidt, M.S., Wittmann, V., & Mayer, G. (2011) ACS Chem. Biol., 6, 675–678.
著者紹介Author Profile
 片山 由紀(かたやま ゆき)
片山 由紀(かたやま ゆき)順天堂大学医学部微生物学講座助教.医学博士,薬剤師,ICD(Infection Control Doctor).
略歴福井県生まれ.1995年共立薬科大学(現:慶応義塾大学)薬学部卒業,同大学大学院薬学研究科修士課程修了(研究室:順天堂大学平松啓一教授),順天堂大学大学院医学研究科博士課程修了,2001年カリフォルニア大学サンフランシスコ校医学部感染症科研究員(研究室:H.F. Chambers教授),03年順天堂大学医学部細菌学講座助教.15年順天堂大学医学部微生物学講座助教,至現在.
研究テーマと抱負ヒト微生物叢(Mictobiota)や病原性細菌の疫学,毒性,薬剤耐性,宿主感染免疫,分子生物学,遺伝子解析.抗菌薬耐性菌の出現と拡散を抑制するため,適切な抗菌薬化学療法,迅速な診断と予防法の臨床開発,院内や市中感染対策に貢献して1人でも多くの人を救っていきたい.
ウェブサイトhttp://qq4q.biz/tcqFまたはhttps://www.juntendo.ac.jp/graduate/kenkyudb/search/researcher.php?MID=784
趣味芸術鑑賞,お料理,読書,ゴルフ,ピアノ,Social dance.