がん細胞と正常細胞のエネルギー代謝は大きく異なる.つまり,がん細胞は通常酸素濃度下にあっても自身のエネルギー産生をTCA回路,電子伝達系によらず,解糖系に依存するという代謝的特徴を持つ.このがん細胞の特性は発見者の名前にちなんで「ワールブルグ効果」と呼ばれているが,近年の代謝研究の再興によってこのような代謝特性を獲得するメカニズムが徐々に分子レベルで説明できるようになってきた.これまでの研究では,このような代謝リモデリングはp53やc-Myc, HIF1αなどのストレス応答性転写因子群による代謝酵素遺伝子の発現誘導の結果起こると説明されてきた.しかし,近年,周囲の環境やストレス応答による細胞内代謝の変動が代謝酵素タンパク質の翻訳後修飾動態を変化させ,エネルギー代謝を制御するという新しいメカニズムが一般的に受け入れられつつある.
本稿では,代謝依存性に変化する翻訳後修飾に焦点を当て,そのなかでも特に,最近我々が明らかにしたアルギニンメチル化修飾による解糖系の制御機構について概説する.
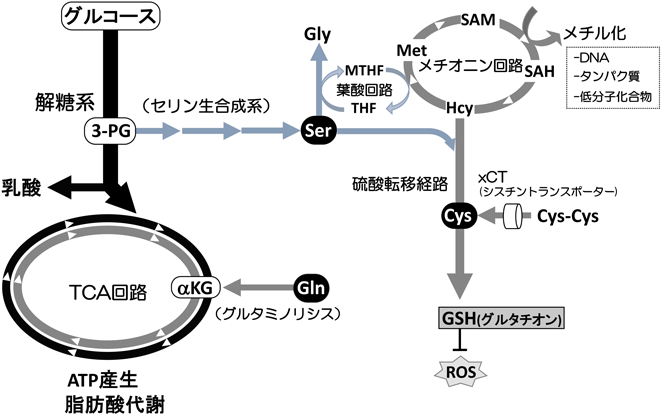
がん細胞はその急速な細胞分裂・細胞増殖を賄うため,アミノ酸や核酸の合成,細胞膜の材料となる膜脂質成分などのバイオマスの迅速な供給を必要とする.興味深いことに,これら生合成経路の多くは解糖系から分岐するものが多い.このような理由から,ATP産生とともに細胞分裂・細胞増殖に必須なバイオマス合成を亢進するために,がん細胞はグルコースの取り込みを増やし解糖系を好んで利用するものと考えられている.さらに,最近の代謝研究の発展により,グルコース代謝以外の代謝系においても正常細胞との差異が明らかになってきた.ここでは,その代表的なアミノ酸代謝系を紹介する(図1).
1)グルタミン
グルタミンは培養細胞の培養液中に大量に含まれており,窒素や炭素骨格の供給源として細胞機能の維持に重要なアミノ酸である.GlutaMAXなる培地サプリメントも売られているので細胞の増殖に重要なアミノ酸であると直感的に理解されている方も多いであろう.がん細胞では解糖系を活性化させつつもTCA回路中間体も重要な炭素骨格として利用されることが近年の研究からわかってきた.すなわち,解糖系の亢進により乳酸発酵が進むが,TCA回路はそれとは別経路で活性化されていることになる.グルタミンはグルタミン合成酵素(glutamine synthase:GLS)によってグルタミン酸に変換され,さらにグルタミン酸脱水素酵素(glutamate dehydrogenase:GLUD)によってα-ケトグルタル酸(αKG)となり,TCA回路に流入する.これをグルタミノリシスと呼び,その炭素骨格は脂質合成,タンパク質合成のための重要な炭素源として使われる1).また一方で,グルタミノリシスで生じたαKGは酸素添加反応の基質としても作用するが,酸素添加反応の多くは核内におけるDNAや転写因子の脱メチル化などにも作用することから,エピジェネティックな制御にも重要であることが注目されている.
2)システイン
システインは含硫アミノ酸の一つで細胞の抗酸化ストレスに重要なアミノ酸であり,タウリン,グルタチオン(GSH),硫化水素(H2S)合成の基となるアミノ酸である.システインは同じ含硫アミノ酸であるメチオニンから硫酸転移経路を経由して生合成が可能であるが,がん細胞の中にはシスチントランスポーター(xCT)を高発現させているものも存在する.佐谷らのグループは,がん幹細胞においてがん幹細胞マーカーである表面抗原分子CD44がxCTと相互作用し,膜上での構造を安定化させることを報告している.xCTにより取り込まれたシスチンはグルタチオンの合成を活性化し,がん幹細胞における酸化ストレス耐性獲得に寄与している(図2)2).
3)セリン
セリンは解糖系から分岐する代謝経路によって合成される非必須アミノ酸である.近年の研究からセリン生合成系と解糖系代謝経路とのクロストークが明らかになった.セリンは解糖系律速酵素ピルビン酸キナーゼ(pyruvate kinase M2:PKM2)のアロステリック活性化因子であり3),細胞内にセリンが十分量ある場合はPKM2を活性化することで解糖系を亢進する.しかしセリン濃度が低下する際にはPKM2活性が低下し解糖系流量が低下することで,取り込んだグルコースはセリン合成系へとスイッチングすることがわかっている.さらに最近Vousdenらのグループは,生合成されたセリンが葉酸代謝を介してメチオニン代謝変動に作用し,がん細胞におけるDNAメチル化制御にも影響を及ぼすことを報告している4).
近年,代謝変動と翻訳後修飾のリンクが注目されている.その中でも翻訳後修飾による代謝のリモデリング機構は特に注目を集めている.たとえば,リン酸化は最もメジャーな翻訳後修飾様式で細胞内のさまざまなシグナル伝達系に関わっていることは周知のとおりであるが,エネルギー代謝のスイッチングにおいても大きな役割を担っている.たとえば,解糖系からTCA回路へのgatekeeperであるピルビン酸脱水素酵素(pyruvate dehydrogenase:PDH)はリン酸化によってその活性が制御される.PDHのリン酸化酵素であるPDK1(pyruvate dehydrogenase kinase 1)は低酸素状況下において発現が誘導されることが知られており,がん細胞のみならず幹細胞の代謝リモデリングにも重要な働きをしている5).
また,アセチル化は細胞内アセチルCoAのアセチル基を修飾のドナーとする点において,代謝物依存性の修飾様式である6).アセチルCoAはTCA回路より産出される中間代謝物質であるが,一説にはミトコンドリアタンパク質の約半数以上は何らかのアセチル化修飾を受けていると考えられている.アセチルCoAはミトコンドリア内膜を通過できないが,細胞質や核内のアセチルCoAはACL(ATP-citrate lyase)によるクエン酸からの変換で賄われている.乳酸脱水素酵素(lactate dehydrogenase:LDH)やペントースリン酸回路の律速酵素G6PD(glucose-6-phosphate dehydrogenase),あるいはピルビン酸キナーゼ(PKM2)など多くの解糖系酵素がアセチル化によって活性が制御されることが報告されている.
近年新しい修飾動態も注目されている.タンパク質のセリンもしくはトレオニン残基にO-GlcNAc(O-linked-N-acetylglucosamine)が付加されるGlcNAc修飾という修飾様式である.N-acetylglucosamineは,解糖系中間体のフルクトース6-リン酸(F-6-P)より分岐し,ヘキソサミン合成経路を経て合成されるが,この代謝経路はグルコースの取り込み量に依存するのが特徴的であり,グルコースを大量に消費するがん細胞において活性化している翻訳後修飾である7).この修飾はOGT(O-GlcNAc transferase)という転移酵素によって触媒される.現在までの研究で,複数の主要代謝系酵素がO-GlcNAc化を受けることが明らかにあり8),その作用機序とエネルギー代謝制御の解明が待たれるところである.
それぞれの翻訳後修飾と代謝制御に関する各論は紙面の関係上,他の総説9)に譲るが,我々はその中でもタンパク質のメチル化修飾に焦点を当ててこれまで研究を行ってきた.次節では含硫アミノ酸代謝依存性に変化するメチル化制御機構とその標的因子の一つである解糖系酵素PFKFB3について解説する.
4. メチオニン代謝に起因するメチル化修飾を介した解糖系制御
1)CO/CBS系によるメチオニン代謝制御・一酸化炭素との意外な接点
メチル化修飾もまた,先に紹介した修飾同様に代謝依存性に制御される翻訳後修飾様式である.メチル基供与体としては,メチオニン代謝系の中間代謝物であるS-アデノシルメチオニン(SAM)が使われる.メチオニン代謝は葉酸代謝,コリン–ベタインの代謝系とも共役していることから,環境要因によってDNAやクロマチン構成因子のメチル化のパターンに影響を与える例が数多く示されている.
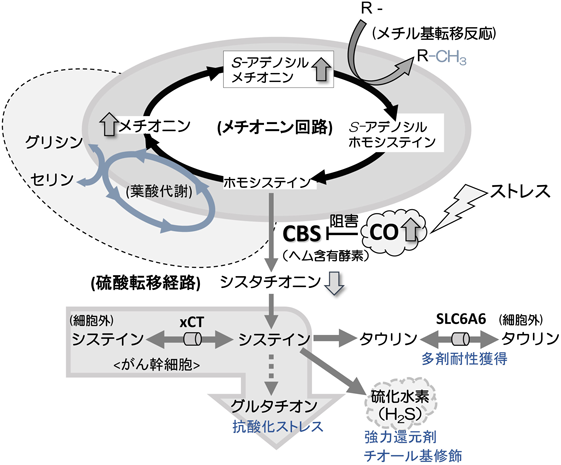
筆者らが所属する研究室は,NOやCO, H2Sなどの生体内ガスシグナル分子がどのように産生され,どのように作用するかを解明する「ガスバイオロジー」研究を推進してきた10, 11).その過程で,主要代謝経路の律速酵素のいくつかがヘム含有酵素であることに着目し,COが作用する代謝経路を探索するためにラットおよびマウスのCO過剰産生モデルを用いたメタボローム解析を施行したところ,含硫アミノ酸代謝酵素であるシスタチオニンβ-シンターゼ(cystathionine β-synthase:CBS)の前後で代謝プロファイルに変化が認められた.作用機序を精査するとCBSはCOによって活性が制御されるヘム含有酵素であることがわかり,ストレス応答性に産出されたCOがCBS活性を調節することによってメチオニン代謝制御に作用することが明らかとなった12).さらにCO/CBS系がタンパク質のメチル化修飾動態に作用するか否かを調べるために,抗メチルアルギニン抗体を用いたウェスタンブロット解析を行った.その結果,CO投与量依存的にタンパク質のメチル化が亢進していることがわかった.このような効果はメチル化阻害剤やCBSノックダウン細胞にて減弱することから,CO/CBS系は新規のメチル化制御物質であることが示唆された(図2)12).
2)タンパク質のアルギニンメチル化修飾
タンパク質のメチル化修飾は,主にリシンおよびアルギニン残基に導入される.そのうち,アルギニン残基のメチル化はアルギニンメチル化酵素(protein arginine methyltransferase:PRMT)によって触媒される.PRMTはtype I(PRMT1~4, 6, 8)とtype II(PRMT5, 7)に分類され,type Iは非対称性ジメチル化,type IIは対称性ジメチル化に寄与する.もともとメチル化修飾に関する研究は,核タンパク質,とりわけヒストン修飾の研究から派生したものが多く,それ以外の細胞質や細胞小器官内でのメチル化タンパク質に関する研究はあまり進んでこなかった実情があるが,近年のタンパク質実験に関する技術革新の恩恵により新規メチル化分子も徐々に明らかになってきた13).PRMTの個々のサブタイプの特性および制御機構に関する詳細については他の優れた総説を参考にされたい14).筆者らも抗メチル化アルギニン抗体を用いてプロテオミクス解析からCO/CBS系で作動するメチル化標的分子の探索にあたってきたが,次項では最近我々が発見した新規メチル化標的分子について紹介する.
3)解糖系酵素PFKFB3のメチル化動態による解糖系制御
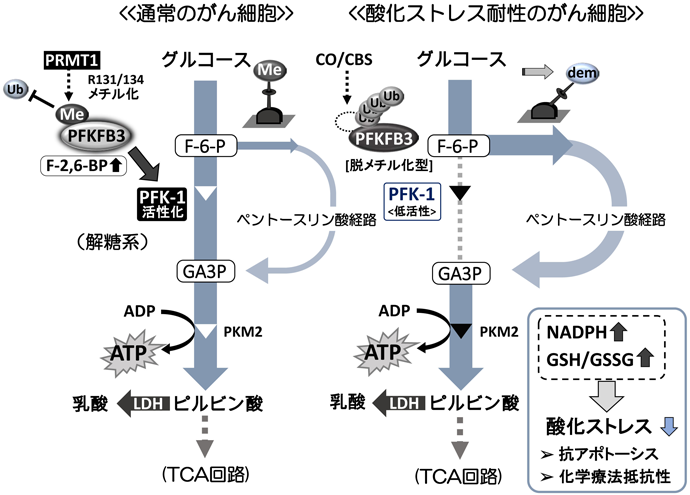
COには抗炎症や抗アポトーシスなどの生理活性があることが報告されている10).誘導性のCO産生酵素であるヘムオキシゲナーゼ1(heme oxygenase-1:HO-1)の発現とがん細胞の生存力,あるいは抗がん剤に対する抵抗性との関連も知られているが,具体的な作用機構は不明であった11).我々はヒト単球細胞株U937細胞にHO-1誘導剤であるヘミンを添加するCO過剰産生モデルを用いて,安定同位体標識13C6-グルコースを細胞に取り込ませ,追跡実験を行った.その結果,取り込まれたグルコースは解糖系律速酵素ホスホフルクトキナーゼ(phosphofructokinase-1:PFK-1)の下流で減少しているものの,おもにG6Pからペントースリン酸回路へ迂回して代謝されていることがわかった.PFK-1はATPやクエン酸などさまざまなアロステリック因子によって活性が制御されるが,我々の実験によってCO/CBS系がPFK-1のアロステリック活性化因子であるフルクトース2,6-ビスリン酸(F-2,6-BP)量を制御し,CO添加時においてF-2,6-BP量が著明に減少していることが明らかとなった(図3)15).
F-2,6-BPの合成酵素であるPFKFB(6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase)には4種のアイソザイムが存在し,その一つであるPFKFB3は胚性細胞やがん細胞など増殖の速い細胞で高発現しており,解糖系亢進に寄与していることが知られている.ヘミンやCOの添加の前後でPFKFB3のmRNAレベルに差を確認できなかったことから,CO/CBS系によるF-2,6-BP量の低下はPFKFB3のmRNA発現量調節ではなく,翻訳後修飾の違いに起因するのではないかと考えた.PFKFB3の一次構造をながめるとR-X-R-(R)からなる配列が2か所存在する.これは先述のアルギニンメチル化酵素PRMTによって認識されうる配列であることから,リコンビナントタンパク質を用いin vitroメチル化アッセイを行った.その結果,PFKFB3の131番目および134番目のアルギニン残基をPRMT1によってジメチル化を受ける責任残基として同定した15).さらに我々はメチル化型PFKFB3のみを特異的に認識する抗体を作製し,細胞内におけるPFKFB3のメチル化動態を検討した.その結果,修飾残基の近傍にユビキチン化されるリシン残基が存在し,メチル化とユビキチン化が拮抗することがわかった15).すなわち,メチル化型PFKFB3はユビキチン化を免れ安定化するが,脱メチル化型は速やかにポリユビキチン化されプロテアソーム系により分解される.つまり,取り込まれたグルコースが解糖系をそのまま進むか,ペントースリン酸回路に迂回して代謝されるかが,PFKFB3のメチル化動態の違いにより規定されているのである(図3).
では,取り込んだグルコースを解糖系から分岐しペントースリン酸回路に迂回した場合の,がん細胞にとってのメリットは何であろうか? ペントースリン酸回路は,核酸の原料となる五炭糖および還元当量であるNADPHを生み出すのに重要な代謝系である.CO/CBS系によりペントースリン酸回路が活性化された細胞では,NADPHおよび還元型グルタチオン量が増加し,結果として活性酸素種(reactive oxygen species:ROS)の産生量を抑えていた.また,CBSをノックダウンすることによって人為的にPFKFB3の低メチル化を誘導したがん細胞は酸化ストレスに対し耐性を有しており,白金製剤に分類される抗がん剤シスプラチンで処理するとコントロール細胞に比べ抗がん効果が減弱していた15).さらに,免疫不全マウスを用いたヒト大腸がん細胞HCT116を用いた肝転移モデルにおいてもCBSノックダウン細胞では肝臓内における腫瘍占有率が高く,質量顕微鏡を用いた解析からは腫瘍内のグルタチオンの還元型/酸化型比率(GSH/GSSG)も高いこともわかった(図3).これらの実験結果から,PFKFB3のメチル化動態が糖代謝における解糖系とペントースリン酸回路のスイッチングに作用し,がん細胞の抗酸化ストレス耐性獲得の一因となっていることが明らかとなった15).
近年の研究により,ストレス応答による代謝変動が翻訳後修飾をコントロールし,結果的に代謝リモデリングに作用する機構の重要性が認識されるようになってきた.その全貌はいまだ明らかではないが,まずはそれぞれの作用分子および修飾メカニズムを正確に知ることが必須であると考える.また,一つの酵素に対し複数の翻訳後修飾がクロストークしている,あるいは他の酵素の修飾動態などが相乗的に影響しあってがん細胞のエネルギー代謝を制御している可能性も十分考慮すべきである.今後は,遺伝子発現,タンパク質発現プロファイルおよび代謝解析を通じて,より多面的,体系的視野に立ってがん細胞の代謝酵素の制御機構を理解し,「アキレス腱」となりうるその代謝特性を明らかにすることが重要になってくるであろう.今回我々が明らかにしたがん細胞の代謝制御メカニズムに関しても,PFKFB3のメチル化・脱メチル化の制御などの詳細な機序はいまだ不明であるが,今後人為的にがん細胞の糖代謝スイッチングを制御して酸化ストレスに対する脆弱性を誘導できれば,新しい治療戦略の開発に役立つものと期待できる.
謝辞Acknowledgments
本稿後半で紹介したメチル化修飾による解糖系制御機構に関する研究は,JST-ERATO末松ガスバイオロジープロジェクトによって行われたものである.ラボメンバーをはじめ,研究を進める上でご助言,ご指導いただいたすべての方々にこの場を借りて御礼申し上げる.
引用文献References
1) DeBerardinis, R.J., Mancuso, A., Daikhin, E., Nissim, I., Yudkoff, M., Wehrli, S., & Thompson, C.B. (2007) Proc. Natl. Acad. Sci. USA, 104, 19345–19350.
2) Ishimoto, T., Nagano, O., Yae, T., Tamada, M., Motohara, T., Oshima, H., Oshima, M., Ikeda, T., Asaba, R., Yagi, H., Masuko, T., Shimizu, T., Ishikawa, T., Kai, K., Takahashi, E., Imamura, Y., Baba, Y., Ohmura, M., Suematsu, M., Baba, H., & Saya, H. (2011) Cancer Cell, 19, 387–400.
3) Chaneton, B., Hillmann, P., Zheng, L., Martin, A.C., Maddocks, O.D., Chokkathukalam, A., Coyle, J.E., Jankevics, A., Holding, F.P., Vousden, K.H., Frezza, C., O’Reilly, M., & Gottlieb, E. (2012) Nature, 491, 458–462.
4) Maddocks, O.D., Labuschagne, C.F., Adams, P.D., & Vousden, K.H. (2016) Mol. Cell, 61, 210–221.
5) Takubo, K., Nagamatsu, G., Kobayashi, C.I., Nakamura-Ishizu, A., Kobayashi, H., Ikeda, E., Goda, N., Rahimi, Y., Johnson, R.S., Soga, T., Hirao, A., Suematsu, M., & Suda, T. (2013) Cell Stem Cell, 12, 49–61.
6) Verdin, E. & Ott, M. (2015) Nat. Rev. Mol. Cell Biol., 16, 258–264.
7) Hardivillé, S. & Hart, G.W. (2014) Cell Metab., 20, 208–213.
8) Jiang, K., Gao, Y., Hou, W., Tian, F., Ying, W., Li, L., Bai, B., Hou, G., Wang, P.G., & Zhang, L. (2016) Amino Acids, doi. 10.1007/s00726-015-2089-8 (in press).
9) Hitosugi, T. & Chen, J. (2014) Oncogene, 33, 4279–4285.
10) Kajimura, M., Fukuda, R., Bateman, R.M., Yamamoto, T., & Suematsu, M. (2010) Antioxid. Redox Signal., 13, 157–192.
11) Suematsu, M., Nakamura, T., Tokumoto, Y., Yamamoto, T., Kajimura, M., & Kabe, Y. (2016) Microcirculation, doi: 10.1111/micc.12253 (in press).
12) Yamamoto, T., Takano, N., Ishiwata, K., & Suematsu, M. (2011) J. Clin. Biochem. Nutr., 48, 96–100.
13) Biggar, K.K. & Li, S.S. (2015) Nat. Rev. Mol. Cell Biol., 16, 5–17.
14) 山形一行,大徳浩照,深水昭吉(2009)生化学,81, 688–699.
15) Yamamoto, T., Takano, N., Ishiwata, K., Ohmura, M., Nagahata, Y., Matsuura, T., Kamata, A., Sakamoto, K., Nakanishi, T., Kubo, A., Hishiki, T., & Suematsu, M. (2014) Nat. Commun., 5, 3480.
著者紹介Author Profile
 山本 雄広(やまもと たけひろ)
山本 雄広(やまもと たけひろ)慶應義塾大学医学部医化学教室講師.理学博士.
略歴1975年北海道函館市に生る.99年北海道大学理学部生物科学科卒業,2004年同大学院理学研究科生物科学専攻博士課程修了,同年慶應義塾大学医学部21世紀COE研究員,07年慶應義塾大学医学部医化学教室助教,15年同講師.
研究テーマと抱負環境変化やストレス応答によって変化する翻訳後修飾全般に興味を持っている.現在がん細胞や免疫担当細胞を中心に代謝変動と翻訳後修飾動態との接点を探っているが,いずれ発生生物学の分野にも代謝生化学的概念を持ち込みたいと考えている.
ウェブサイトwww.gasbiology.com
趣味野球観戦,鉄道旅行(乗り鉄).