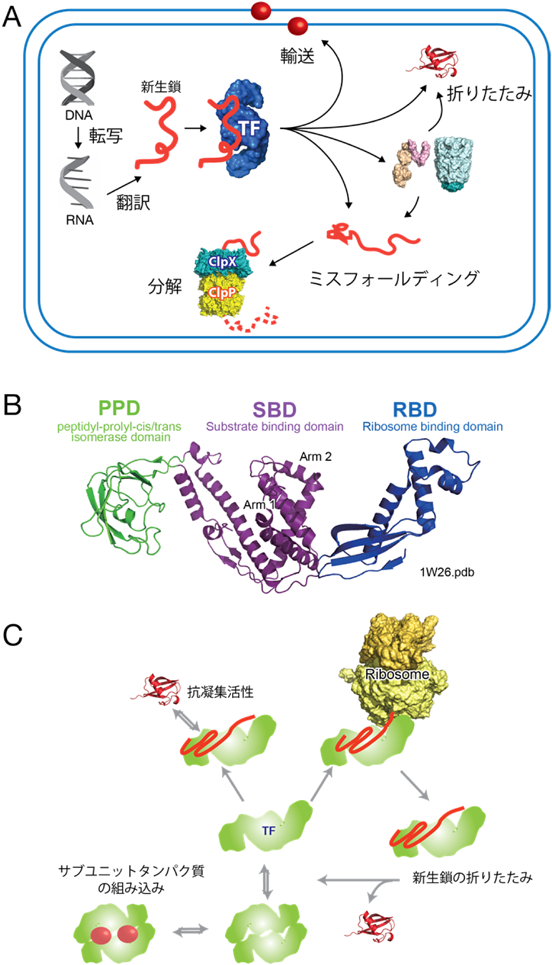
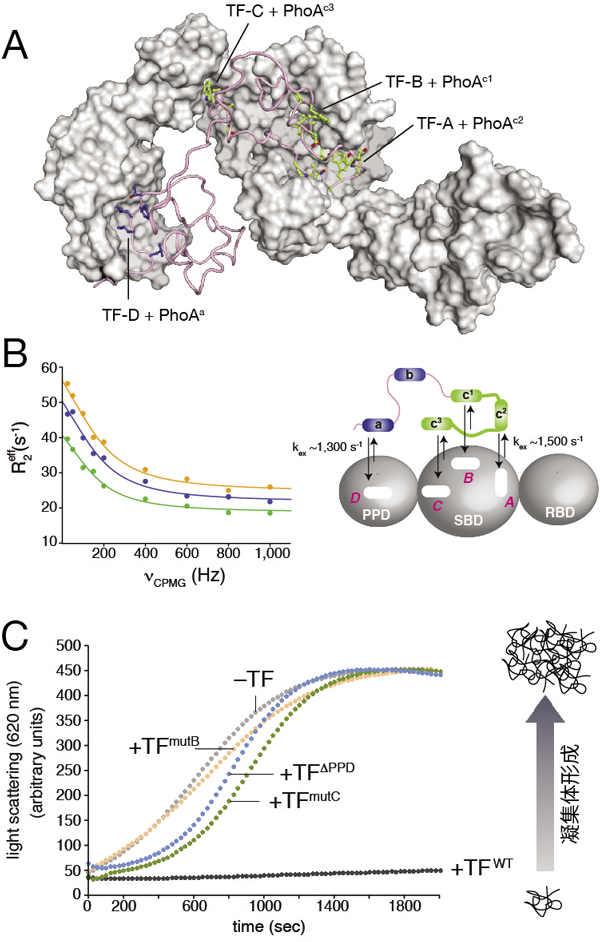
トリガーファクターシャペロンによる動的基質認識の構造基盤Dynamic Recognition of Unfolded Proteins by the Trigger Factor Chaperone as investigated by NMR
1 北海道大学大学院理学研究院化学部門Graduate School of Chemical Sciences and Engineering, Hokkaido University ◇ 〒060–0810 札幌市北区北10条西8丁目理学部7号館 ◇ School of Science Bldg. 7, Kita 10-jo Nishi 8-chome, Kita-ku, Sapporo 〒060–0810
2 北海道大学大学院総合化学院Department of Chemistry, Faculty of Science, Hokkaido University ◇
3 JSTさきがけPRESTO, JST ◇