細胞は,種々の細胞外刺激によりさまざまな細胞応答を引き起こす.それらの応答には,細胞移動,細胞分裂,細胞突起伸展や退縮等の細胞形態変化を伴う過程も含まれる.これまでさまざまな細胞において,細胞外刺激の一種である三量体GTP結合タンパク質(三量体Gタンパク質)共役型受容体(G-protein-coupled receptor:GPCR)を介するシグナルが,さまざまな細胞形態変化を引き起こすことが報告されてきた.また,それらの分子機構の一つとして,GPCRシグナルの下流で,細胞形態制御機構において重要な働きをすることが知られているRhoA, Rac, Cdc42等を含むRhoファミリー低分子量GTP結合タンパク質(Rho)によるアクチン細胞骨格の時間的空間的な制御が存在することも明らかになってきた.しかしながら,それらの詳細な制御機構は,まだ不明な点が多く存在する.本稿では,その制御機構の一つとして,特に,三量体Gタンパク質のGβγサブユニットにより制御されるRho特異的グアニンヌクレオチド交換因子(Rho guanine nucleotide exchange factor:RhoGEF)について,我々の成果を中心に紹介したい.
一般的にRhoは,他のGTP結合タンパク質(Gタンパク質)と同様に,不活性型のGDP結合型と活性型のGTP結合型の変換により,機能制御が行われる.一般的なGタンパク質と同様に,RhoのGDPとGTPの交換にも,主に二つの細胞内因子が関わっていることが知られている.一つは,上述したRhoのGDP型からGTP型への交換反応を促進し活性化させる分子であるRhoGEF,もう一つは,Gタンパク質が持っているGTP加水分解活性を活性化させる分子で,Rho特異的に作用するGTPアーゼ活性化タンパク質(Rho GTPase-activating protein:RhoGAP)である.これらが細胞内におけるRhoの時間的空間的な制御に関与していると考えられている1).
RhoGEFは,現在,そのタンパク質構造から大きく二つのファミリーの存在が知られている.一つは,Dbl homology (DH)ドメインを含有するDblファミリーRhoGEFと,dedicator of cytokinesis (Dock)homology region (DHR)ドメインを持つDockファミリーRhoGEFである.DblファミリーRhoGEFは,現在,ヒト遺伝子上に少なくとも70種類存在することが知られており,それぞれに種々あるRhoに対する特異性が異なっていることが知られている2).一方,DockファミリーRhoGEFは,現在,ヒト遺伝子上に11種類存在することが知られており,Rhoに対する特異性としては,RacおよびCdc42に対する特異性が高いことが知られている3).
3. 三量体Gタンパク質GβγサブユニットによるDblファミリーRhoGEFの制御
一般的に,三量体Gタンパク質は,Gα, Gβ, Gγの三つのサブユニットから構成されている.三量体Gタンパク質は,GPCRの刺激により,Gαサブユニットに結合しているGDPがGTPに交換され,Gαサブユニットが活性型になると同時に,活性型GαサブユニットとGβγサブユニットに解離し,それぞれが,さまざまなエフェクター分子に作用し,細胞応答に関与することが知られている4).
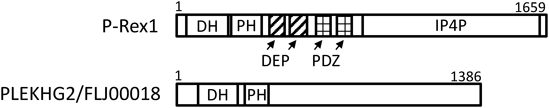
GPCR刺激により遊離したGβγサブユニットにより活性化されるDblファミリー RhoGEFがいくつか報告されている.最も早く報告されたものは,PI 3-キナーゼの働きにより産生されるホスファチジルイノシトール3,4,5-トリスリン酸(phosphatidylinositol 3,4,5-trisphosphate)とGβγサブユニットが直接作用して活性化し,Rhoの一種のRacを特異的に活性化させるphosphatidylinositol 3,4,5-trisphosphate-dependent Rac exchanger (P-Rex)1および2である5, 6).そのタンパク質の構造は,DHドメイン,PHドメインの他に,DEPドメイン,PDZドメインなどの機能ドメインを有している(図1).Gβγサブユニットの結合部位については,各種機能ドメインがこれらの結合に関わっているというものや,DHドメインやPHドメインが重要であるといういくつかの報告があるが,現在のところ,その詳細は不明である.P-Rex1やP-Rex2は,好中球などの走化性や悪性黒色腫細胞や前立腺がん細胞の細胞移動に重要な働きをしているという報告があり,がん細胞の転移や浸潤など病態との関連が注目される.その他,現在までに報告されているGβγサブユニットにより活性化されるDblファミリーRhoGEFには,p114RhoGEFやARHGEF5/TIMなどもある(表1).
表1 Gβγと相互作用することにより直接活性化されるRhoGEF| RhoGEF名 | RhoGEFの機能等 | Rho特異性 |
|---|
| P-Rex1 | 白血球走化性やプルキンエ細胞の形態形成等(Welch et al., 2002, Welch et al., 2005, Donald et al., 2008) | Rac |
| PLEKHG2/FLJ00018 | 細胞伸展制御やリンパ球遊走制御(Ueda et al., 2008, Runne et al., 2013) | Rac/Cdc42 |
| ARHGEF5/TIM | 未成熟骨髄由来樹状細胞走化性(Wang et al., 2009) | RhoA |
| p114RhoGEF | 活性酸素産生と細胞形態制御(Niu et al., 2003) | Rac/RhoA |
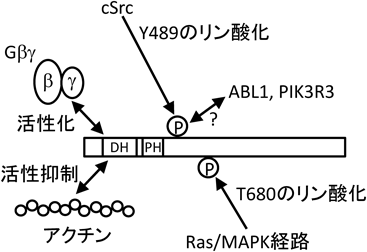
我々は,P-Rex1や2以外にGβγサブユニットにより活性化されるRhoGEFの探索を行い,pleckstrin homology domain containing, family G (with RhoGEF domain)member 2(PLEKHG2)/FLJ00018を同定した7).現在のところ,PLEKHG2のタンパク質構造中には,P-Rex1や2と異なり,DHドメイン,PHドメイン以外に機能ドメインは見いだされず,その構造からRhoGEF以外の機能を推定することは困難である(図1).我々は,Gβγサブユニットの結合部位がN末端付近に存在するDHドメインに存在することを報告した(図2).その後,Runneらが,C末端側にも結合部位が存在することを報告している8).また,P-RexがRacに特異的に働くのに対し,PLEKHG2は,Racだけではなく,Cdc42にも作用する.さらに,PHドメインに対する各種リン脂質との結合についても,P-Rex1のPHドメインは,3位にリン酸基を持つイノシトールリン脂質に結合性を示したが,PLEKHG2のPHドメインは,ポリホスホイノシトールリン脂質およびホスファチジン酸との結合性を示し,両者でリン脂質特異性が異なることが明らかになった9).
P-Rex1をはじめ,多くのRhoGEFは,それぞれが一つの細胞外シグナルだけで制御されるのではなく,複数のシグナルを受けとることができることが知られている.そこで,我々は,PLEKHG2の細胞機能を探るため,他の細胞内シグナルによるPLEKHG2のリン酸化や他の細胞内分子との相互作用について検討した.その一つとして,エフリンB2受容体(EphB2)刺激により活性化される非受容体型チロシンキナーゼの一つであるcSrcシグナルにより,PLEKHG2の489番目のチロシンがリン酸化されることが明らかになった(図2).また,このリン酸化チロシンには,別のチロシンキナーゼであるABL1やPI 3キナーゼの調節サブユニットであるPIK3R3が,それら分子が持つSrc homology 2ドメインを介して相互作用することを明らかにした10).さらに,最近,上皮成長因子受容体(epidermal growth factor receptor:EGFR)シグナルのβアドレナリン受容体刺激によるトランス活性化,あるいは,上皮成長因子による直接的な活性化により活性化されるRas/MAPキナーゼ経路を介して,PLEKHG2の680番目のトレオニンがリン酸化されることも見いだした(図2).このトレオニンのリン酸化は,PLEKHG2のRhoGEF活性自体に直接影響を与えないが,Neuro-2a細胞において,EGFRによる突起伸展に影響を与えることを明らかにした11).一方,酵母ツーハイブリッド法による相互作用タンパク質の探索の結果,細胞内アクチンが相互作用することが明らかになった.さらに,この相互作用はGβγサブユニットによるPLEKHG2のRhoGEF活性上昇を抑制することも明らかになった(図2).また,アクチンは細胞内で球状アクチンと繊維状アクチンの二つの状態で存在し,活性化RacおよびCdc42は,繊維状アクチン量を増やすと考えられる.そして,細胞内アクチンは繊維状アクチンとしてPLEKHG2と結合しているという結果を得たことから,PLEKHG2と細胞内アクチンとの相互作用は,PLEKHG2活性化に対するネガティブフィードバック作用を持つものと考えられた12).