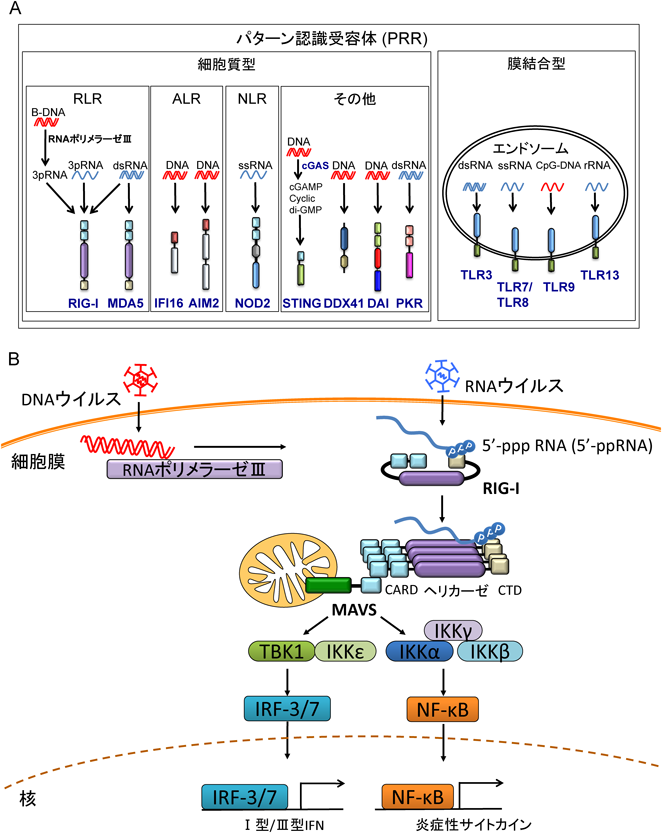
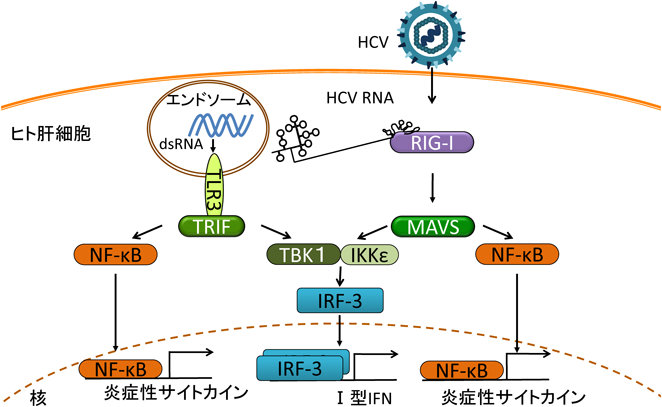
肝炎ウイルスに対するパターン認識受容体を介する自然免疫認識機構Pattern recognition receptor-mediated sensing mechanism during hepatitis virus infection
1 北海道大学遺伝子病制御研究所分子生体防御分野Division of Signaling in Cancer and Immunology, Institute for Genetic Medicine, Hokkaido University ◇ 〒060–0815 北海道札幌市北区北15条西7丁目 ◇ Kita-15, Nishi-7, Kita-ku, Sapporo, Hokkaido, 060–0815, Japan
2 北海道大学大学院総合化学院生物化学コース分子医化学講座Molecular Medical Biochemistry Unit, Biological Chemistry and Engineering Course, Graduate school of Chemical Sciences and Engineering, Hokkaido University ◇ ◇
3 北海道大学大学院医学研究科Graduate School of Medicine, Hokkaido University ◇ ◇