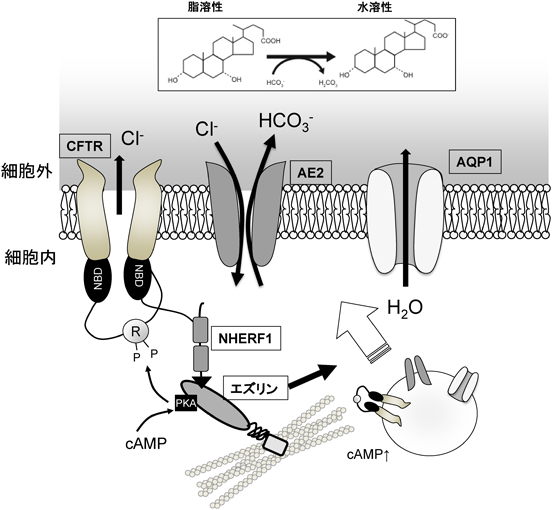
上皮膜輸送機能制御における細胞骨格系アダプタータンパク質エズリンの役割Functional roles of ezrin, a cytoskeletal adaptor protein in the regulation of epithelial transport
立命館大学薬学部分子生理学研究室College of Pharmaceutical Sciences, Ritsumeikan University ◇ 〒525–8577 滋賀県草津市野路東1–1–1 ◇ 1–1–1 Noji-Higashi, Kusatsu, Shiga 525–8577, Japan