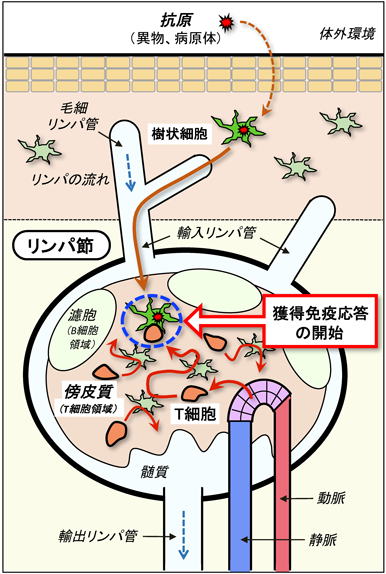
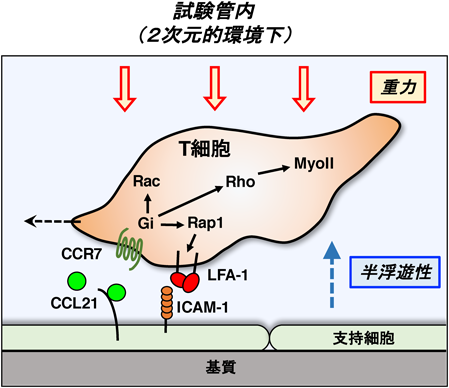
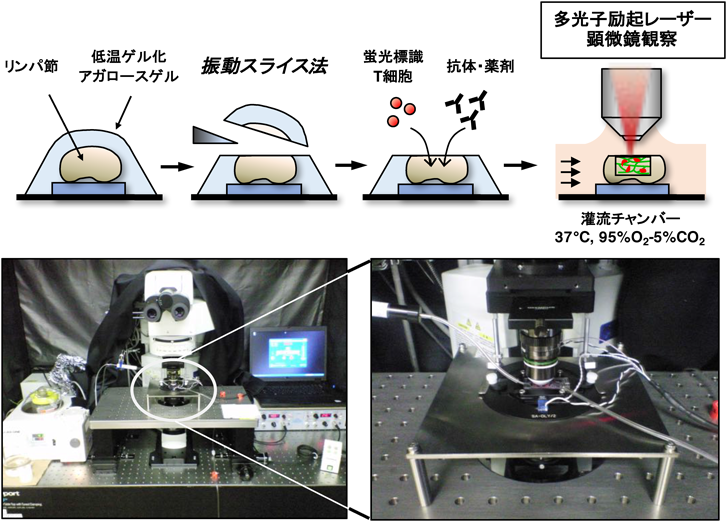
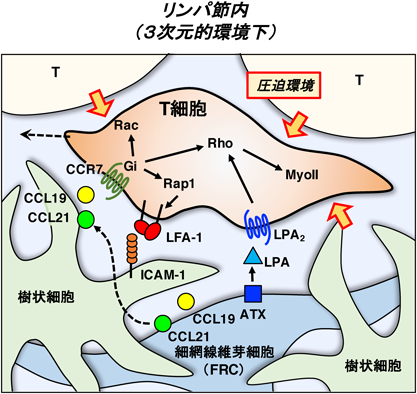
3) Miller, M.J., Wei, S.H., Parker, I., & Cahalan, M.D. (2002) Science, 296, 1869–1873.
7) Hogg, N., Laschinger, M., Giles, K., & McDowall, A. (2003) J. Cell Sci., 116, 4695–4705.
9) Nishikimi, A., Kukimoto-Niino, M., Yokoyama, S., & Fukui, Y. (2013) Exp. Cell Res., 319, 2343–2349.
10) Ridley, A.J. (2001) J. Cell Sci., 114, 2713–2722.
12) Nombela-Arrieta, C., Mempel, T.R., Soriano, S.F., Mazo, I., Wymann, M.P., Hirsch, E., Martinez, A.C., Fukui, Y., von Andrian, U.H., & Stein, J.V. (2007) J. Exp. Med., 204, 497–510.
13) Faroudi, M., Hons, M., Zachacz, A., Dumont, C., Lyck, R., Stein, J.V., & Tybulewicz, V.L.J. (2010) Blood, 116, 5536–5547.
15) Worbs, T., Mempel, T.R., Bölter, J., von Andrian, U.H., & Förster, R. (2007) J. Exp. Med., 204, 489–495.
16) Woolf, E., Grigorova, I., Sagiv, A., Grabovsky, V., Feigelson, S.W., Shulman, Z., Hartmann, T., Sixt, M., Cyster, J.G., & Alon, R. (2007) Nat. Immunol., 8, 1076–1085.
17) Lämmermann, T., Bader, B.L., Monkley, S.J., Worbs, T., Wedlich-Söldner, R., Hirsch, K., Keller, M., Förster, R., Critchley, D.R., Fässler, R., & Sixt, M. (2008) Nature, 453, 51–55.
18) Scharffetter-Kochanek, K., Lu, H., Norman, K., van Nood, N., Munoz, F., Grabbe, S., McArthur, M., Lorenzo, I., Kaplan, S., Ley, K., Smith, C.W., Montgomery, C.A., Rich, S., & Beaudet, A.L. (1998) J. Exp. Med., 188, 119–131.
20) Katakai, T., Hara, T., Sugai, M., & Shimizu, A. (2004) Int. Immunol., 16, 1133–1142.
21) Katakai, T., Hara, T., Sugai, M., & Shimizu, A. (2004) J. Exp. Med., 200, 783–795.
22) Bajénoff, M., Egen, J.G., Koo, L.Y., Laugier, J.P., Brau, F., Glaichenhaus, N., & Germain, R.N. (2006) Immunity, 25, 989–1001.
25) Jacobelli, J., Friedman, R.S., Conti, M.A., Lennon-Dumenil, A.M., Piel, M., Sorensen, C.M., Adelstein, R.S., & Krummel, M.F. (2010) Nat. Immunol., 11, 953–961.
27) Katakai, T., Kondo, N., Ueda, Y., & Kinashi, T. (2014) J. Immunol., 193, 617–626.
28) Zhang, Y., Chen, Y.C., Krummel, M.F., & Rosen, S.D. (2012) J. Immunol., 189, 3914–2924.
29) Knowlden, S.A., Capece, T., Popovic, M., Chapman, T.J., Rezaee, F., Kim, M., & Georas, S.N. (2014) PLoS ONE, 9, e101655.
30) Takeda, A., Kobayashi, D., Aoi, K., Sasaki, N., Sugiura, Y., Igarashi, H., Tohya, K., Inoue, A., Hata, E., Akahoshi, N., Hayasaka, H., Kikuta, J., Scandella, E., Ludewig, B., Ishii, S., Aoki, J., Suematsu, M., Ishii, M., Takeda, K., Jalkanen, S., Miyasaka, M., & Umemoto, E. (2016) eLife, 5, e10561.
31) Choi, J.W., Herr, D.R., Noguchi, K., Yung, Y.C., Lee, C.W., Mutoh, T., Lin, M.E., Teo, S.T., Park, K.E., Mosley, A.N., & Chun, J. (2010) Annu. Rev. Pharmacol. Toxicol., 50, 157–186.
32) Herroeder, S., Reichardt, P., Sassmann, A., Zimmermann, B., Jaeneke, D., Hoeckner, J., Hollmann, M.W., Fischer, K.D., Vogt, S., Grosse, R., Hogg, N., Gunzer, M., Offermanns, S., & Wettschureck, N. (2009) Immunity, 30, 708–720.
33) Gerard, A., Patino-Lopez, G., Beemiller, P., Nambiar, R., Ben-Aissa, K., Liu, Y., Totah, F.J., Tyska, M.J., Shaw, S., & Krummel, M.F. (2014) Cell, 158, 492–505.
34) Smith, A., Bracke, M., Leitinger, B., Porter, J.C., & Hogg, N. (2003) J. Cell Sci., 116, 3123–3133.
35) Morin, N.A., Oakes, P.W., Hyun, Y.M., Lee, D., Chin, Y.E., King, M.R., Springer, T.A., Shimaoka, M., Tang, J.X., Reichner, J.S., & Kim, M. (2008) J. Exp. Med., 205, 195–205.
36) Jacobelli, J., Bennett, F.C., Pandurangi, P., Tooley, A.J., & Krummel, M.F. (2009) J. Immunol., 182, 2041–2050.