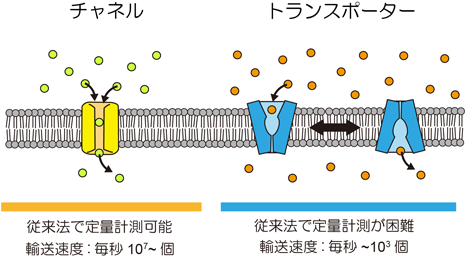
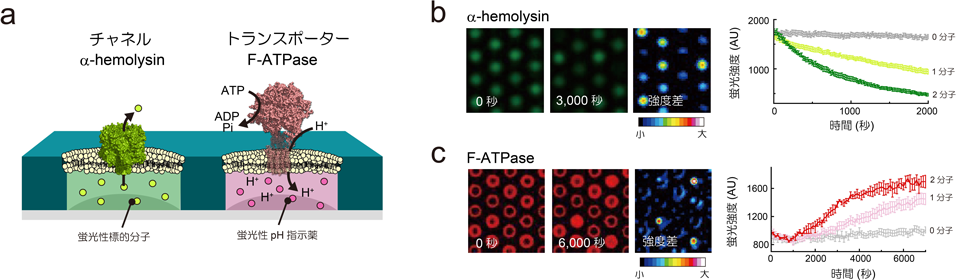
マイクロチップが実現する膜タンパク質の高感度機能分析Microsystems allow highly sensitive analysis of membrane protein functions
東京大学大学院工学系研究科応用化学専攻,科学技術振興機構・さきがけDepartment of Applied Chemistry, School of Engineering, The University of Tokyo. PREST, Japan Science and Technology Agency (JST) ◇ 〒113–8656 東京都文京区本郷7–3–1 工学部3号館6B03号室 ◇ Eng. Bld. #3 6B03, 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–8656, Japan