マラリアは単細胞性の寄生虫であるマラリア原虫によって引き起こされ,ハマダラカによって媒介される.ハマダラカの吸血時にスポロゾイトと呼ばれる原虫が人体内に注入されると,血流を介して肝臓に到着し肝細胞に侵入する.肝細胞内で形を変え分裂し,1,000~10,000個のメロゾイトになると肝細胞を破壊して血中に移行する.メロゾイトは赤血球に感染し栄養型となり,赤血球中で分裂し最大32個のメロゾイトに増殖すると,感染赤血球を破壊して血中に出て新たな赤血球へと感染を繰り返す.すべてのマラリアの症状,三大徴候である発熱・脾腫・貧血,および熱帯熱マラリア原虫Plasmodium falciparumによる致死性合併症である脳マラリアは赤血球に感染し増殖しているマラリア原虫が一定量を超えたときに生じる.したがって,蚊の刺咬から赤血球ステージの原虫が増えるまでの間が潜伏期間となる.
我々の免疫系はマラリア原虫を排除するためにさまざまな応答を発動する.ハマダラカから侵入したスポロゾイトに対する抗体は,肝細胞への侵入を抑制する.肝臓での感染を食い止められれば,赤血球ステージには進まずに発病することはない.メロゾイトに対する抗体は,メロゾイトの赤血球への感染を阻止し,赤血球ステージの原虫を減ずることで,病態を緩和する.一方で過剰な免疫応答は病態に直結することも知られ,脳マラリアの発症には免疫応答が関与する.このようにマラリアの病態は赤血球ステージのマラリア原虫の多少,免疫応答の強弱が複雑に絡み合い形成されている.
ヒトの腸管には膨大な数,菌種にして1000種100兆個の共生細菌が生息している.共生菌は我々にとって有用であり,その恩恵は,消化吸収の促進から,ビタミンK合成まで幅広い.さらに,病原体侵入の門戸に大量に存在し,病原体が増殖するスペースを競合することで感染から防御している.これは,大量の抗生物質の投与で腸内細菌が減ると,Clostridium difficileによる偽膜性腸炎が発症することからも理解できる.近年,腸内細菌の変調が種々の病態に関わることが示されてきた3).代謝性疾患である糖尿病や肥満だけでなく,統合失調症や自閉症の精神疾患など,腸内細菌叢の関与は多岐にわたる.また,腸内細菌叢が腸管関連免疫組織に所属する多数の免疫系細胞にも影響しており,アレルギーや自己免疫病の発症にも関わっている.実際にある種の細菌が炎症性のT細胞であるTh17,免疫抑制性の制御性T細胞を活性化することが知られている4, 5).
腸内細菌叢による免疫系の制御は感染症に対する抵抗性にも影響を及ぼす.たとえば,全身のウイルス感染症に対する抵抗性獲得に腸内細菌が関与している.抗生物質を投与することで腸内細菌を大幅に減じたマウスでは,自然免疫センサーのインフラマソームを活性化できないことに伴い,インフルエンザウイルスに対する防御応答が減弱する6).同様に,抗生物質投与マウスでは,リンパ球性脈絡髄膜炎ウイルスの防御に重要である抗ウイルス作用を持つI型インターフェロンが誘導されず,このウイルスに対する抵抗性が弱くなる7).いずれにおいても,腸内細菌がインフラマソームやI型インターフェロンという自然免疫系の活性化に重要であった.したがって腸内細菌は上述の獲得免疫系であるT細胞だけでなく,自然免疫をも活性化し全体の免疫応答を調節していることが想定される.
1)蚊の腸内細菌とマラリア伝搬
これまで,マラリアと腸内細菌の関連性を示す報告としては,媒介者のハマダラカの腸内細菌とマラリア原虫との相互作用がいくつか知られているだけであった.マラリア流行域のカメルーンでハマダラカの中腸内の腸内細菌叢を検討したところ,腸内細菌の組成が蚊を採取した場所により異なっており,それは幼虫が発育する水中の細菌群に依存していることが示された.興味深いことに,腸内細菌の組成,特に腸内細菌科の細菌量,と熱帯熱マラリア原虫を伝搬する能力に有意な相関性がみられた8).腸内細菌とマラリア伝播能の密接な関連性は実験的にも示され,腸内細菌科のセラチア菌のある種の分離株がハマダラカの中腸に存在すると,マラリア原虫の蚊への感染が抑制された9).さらには,生殖母体を含む血液に抗生物質を加えてハマダラカに吸血させると,何も加えていない血液を吸血したときに比べて,マラリア原虫の発育がよくなり伝播能が高くなることが示された10).抗生物質を吸血した蚊では中腸内の腸内細菌が減じており,ある種の腸内細菌がマラリア原虫に対する防御効果を付与していることを示唆している.ハマダラカによるマラリア原虫の伝搬能力は,マラリア原虫に対するハマダラカの防御能に依存しており,腸内細菌が防御応答を刺激/抑制していることが想定される.腸内細菌が獲得免疫系を持たない蚊の防御応答にも影響を与えていることは,腸内細菌が自然免疫系の活性化に働いていることを示すものである.
2)哺乳類宿主における腸内細菌によるマラリアに対する防御応答の誘導
以上のようにハマダラカにおける腸内細菌とマラリア原虫の関連性についての報告はあったが,ここ最近でヒトやマウスにおいても報告されてきた.
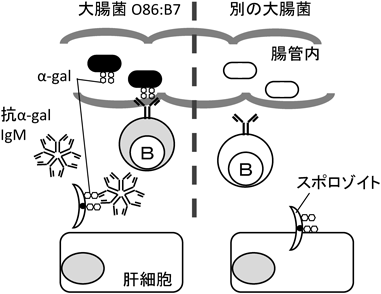
マリでのコホート研究で,マラリア流行時期に熱帯熱マラリア原虫P. falciparumに感染しなかった人と感染した人の流行時期直前の糖鎖Galα1-3Galβ1-4GlcNac-R(α-gal)を認識する抗体価を比較した.感染していない人では有意にIgMが高値を示すことが示され,抗α-gal IgMを持っている人はマラリアにかかりにくいという相関性がみられた11).この抗体はスポロゾイトに発現するα-galに結合する.マラリア感染防御との相関性は抗α-gal IgGではみられなかったことから,腸内細菌による自然抗体(IgM)の誘導が示唆された.
そこで,マウスモデルを用いてその可能性を検証したところ,α-galを発現している大腸菌O86:B7を腸内に移入したマウスでは抗α-gal IgM抗体が産生された.抗α-gal IgMを持つマウスは,スポロゾイトの感染に抵抗性で,肝臓への侵入が抑制されていることも明らかとなった.抗α-gal抗体は赤血球ステージの原虫を認識することはなく,赤血球期のマラリアには効果を持たない.これらの結果は,腸内細菌がスポロゾイトに交差反応する糖鎖に対する自然抗体を誘導することで抗マラリア防御に貢献していることを示すものである(図1).
また,マウスにα-galを免疫することでスポロゾイトに対して防御効果を持つ抗体(この場合はIgM, IgG2b, IgG3)を誘導できる.このことは,α-galをワクチンとして使用できる可能性を示すものである.
3)腸内細菌叢の組成とマラリア抵抗性の関連
マリでの別のコホート研究で,マラリア流行時期の直前の糞便中の腸内細菌叢の組成が流行時期中のP. falciparumマラリア感染の有無と相関することが示された12).感染しなかったグループの糞便中では,ビフィズス菌,連鎖球菌,大腸菌–赤痢菌,ラクトバチルス科などが多く含まれていた.一方で感染したグループではラクノスピラ科とそれに属するブラウティア,ルミノコッカス科などが豊富にみられた.この報告では免疫応答の解析は行われていないが,上述のようにスポロゾイトに結合する抗α-gal抗体がある種の大腸菌によって誘導されることを考慮すると,抵抗性のグループで大腸菌が多くみられるという知見は興味深い.発熱の有無という症状との相関は認められず,感染への抵抗性とのみ相関性があったことからも,腸内細菌がスポロゾイトに対する応答に影響していることが示唆される.
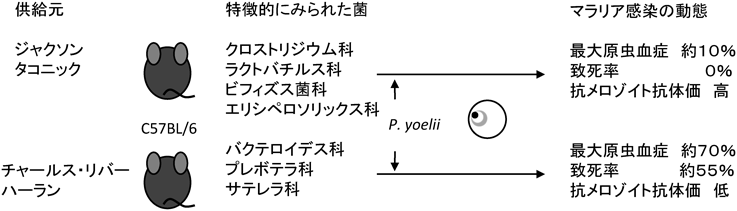
さらには,病態に直結する赤血球ステージの原虫に対する応答にも腸内細菌叢が関与していることがマウスモデルで報告された13).ジャクソン,タコニック,チャールス・リバー,ハーランの4社のC57BL/6マウスにネズミマラリア原虫P. yoeliiの感染赤血球を感染させたところ,ジャクソンとタコニックのマウスでは原虫の増殖が緩やかで一過性感染を起こすが,チャールス・リバーとハーランのマウスは急速に原虫が増殖し,半数のマウスでは致死性となる.遺伝背景が同じマウスでも供給源が違うと,腸内細菌叢の組成が異なることが知られている4)ので,これらのマウスの腸内細菌を検討した.抵抗性のマウスと感受性のマウスでは,腸内細菌の組成に著しい差が認められ,前者ではビフィズス菌科,クロストリジウム科,ラクトバチルス科,ペプトコッカス科が多く,後者ではバクテロイデス科,プレボテラ科,サテレラ科などが多くみられた(図2).無菌マウスに抵抗性および感受性のマウスの糞便を移植し感染させると,抵抗性マウスの糞便の移植された無菌マウスは抵抗性に,感受性マウスのものを移植された無菌マウスは感受性になった.さらに,抗生物質を投与し腸内細菌叢を除去した感受性マウスに,抵抗性マウスで多くみられたビフィズス菌と乳酸菌をヨーグルトとして投与することで抵抗性に変えることができた.免疫学的には,抵抗性のマウスではメロゾイトに対するIgG抗体価が高く,胚中心B細胞,濾胞ヘルパーT細胞,活性化CD4T細胞が多いことから,抗体のクラススイッチを必要とする獲得免疫系が活性化されていることが示唆される.抗α-gal IgMを誘導する大腸菌とは異なるメカニズムで免疫系を調節しているのだろう.
4)マラリア感染が腸内細菌叢に与える影響
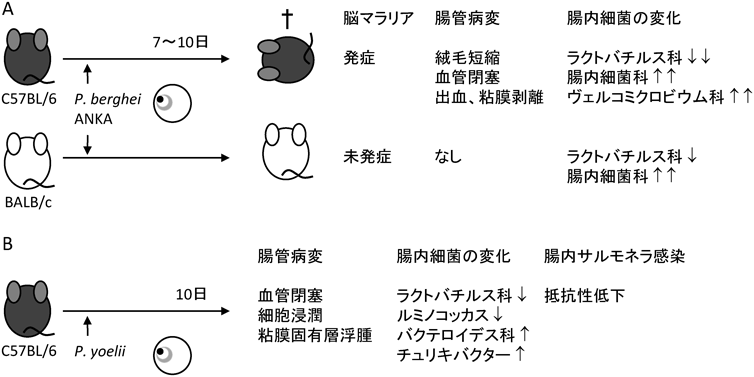
マラリア患者では下痢や腹痛,嘔吐といった消化器症状がよくみられるがその病態形成の詳細,腸内細菌の関与はよくわかっていない.筆者らはマウスモデルを用いてマラリアの腸内病変と腸内細菌を検討した14).ネズミマラリア原虫P. berghei ANKAをC57BL/6マウスに感染させると感染後10日以内に中枢神経症状を呈して死に至り,ヒトにおける熱帯熱マラリアの致死的合併症である脳マラリアのモデルとなる.BALB/cマウスは中枢神経症状を発症することなく,脳マラリア非感受性である.この両者の腸管の組織を検討したところ,C57BL/6マウスでは脳症状を発症時期の感染後9日目に小腸粘膜の脱落,出血,血管の閉塞が認められた.一方で,BALB/cマウスではそのような病理像は認めなった.
腸内細菌叢の解析では,感染前では双方のマウスにおいてバクテロイデス門とファーミキューテス門が優位で大差はなかった.興味深いことに,病態を示さないBALB/cマウスでは感染後も腸内細菌叢に大きな変化はみられなかったが,C57BL/6マウスでは脳症状を示す以前の感染後5日目よりラクトバチルス科の減少,ヴェルコミクロビウム科とそれに含まれるアッカーマンシア,および腸内細菌科の増加を特徴とする劇的な変化がみられた.このように,原虫の存在が腸内細菌叢を変調させることが明らかになった(図3A).さらに原虫血症率,脳マラリア発症という病態と高い相関・逆相関を持つ菌もいくつかみられた.腸内細菌叢の変調がその病態に先んじて生じることも考え合わせると,免疫系に作用するなど病態に影響を与えていることが示唆される.
以上のように,実験モデルではあるがマラリアが腸管病変を引き起こし,腸内細菌叢を変調させることを世界に先駆けて明らかにした.腸管病変は脳マラリアがみられるC57BL/6マウスで顕著にみられたことから,脳マラリアの発症の要因である感染赤血球による血管の閉塞が主な原因と考えられる.しかし,マラリアでの腸内細菌の変調の詳細は不明である.また,ヒトのマラリア患者でもこのような変化が起こるのか,起こっている場合のその病態への影響など,まだまだ検討すべき余地が残っている.これらの疑問に答えるために,筆者らは現在,ウガンダでヒトを対象とした疫学調査を行っている.
マラリア患者では他の感染症に対する防御応答が弱いことも知られているが,この現象にもマラリア感染が腸内細菌を変調させることが重要であるとの報告がなされた15).ネズミマラリア原虫P. yoeliiをC57BL/6マウスに感染させると,感染後10~15日をピークとする原虫血症率の上昇がみられ,30日目には排除される.感染後10日にこれらのマウスにサルモネラを腸内感染させると,対照マウスに比べて多くのサルモネラの腸管内定着を許すことから,マラリア感染マウスではサルモネラの重複感染に対して抵抗性が弱くなる.マラリア感染後10日目には,腸管に組織学的な変化,感染赤血球による血管の閉塞,盲腸での粘膜固有層の浮腫・単核球の局所的な浸潤がみられた.
これら炎症性所見に付随して,腸内細菌叢の変調も認められた.特に,チュリキバクターの増加とルミノコッカスの減少が顕著であった(図3B).このときの盲腸内容物を無菌マウスに移植し,サルモネラを感染させると,通常マウスのものを移植されたマウスに比べて,サルモネラに対する抵抗性が弱いことが明らかになった.このことは,マラリアによって変調した腸内細菌叢がサルモネラに対する抵抗性を抑制していることを示すものである.
引用文献References
1) World Health Organization (2015) World malaria report 2014.
2) Noedl, H., Se, Y., Schaecher, K., Smith, B.L., Socheat, D., & Fukuda, M.M.; Artemisinin Resistance in Cambodia 1 (ARC1) Study Consortium. (2008) N. Engl. J. Med., 359, 2619–2620.
3) Honda, K. & Littman, D.R. (2012) Annu. Rev. Immunol., 30, 759–795.
4) Ivanov, I.I., Atarashi, K., Manel, N., Brodie, E.L., Shima, T., Karaoz, U., Wei, D., Goldfarb, K.C., Santee, C.A., Lynch, S.V., Tanoue, T., Imaoka, A., Itoh, K., Takeda, K., Umesaki, Y., Honda, K., & Littman, D.R. (2009) Cell, 139, 485–498.
5) Atarashi, K., Tanoue, T., Shima, T., Imaoka, A., Kuwahara, T., Momose, Y., Cheng, G., Yamasaki, S., Saito, T., Ohba, Y., Taniguchi, T., Takeda, K., Hori, S., Iwanof, I.I., Umesaki, Y., Itoh, K., & Honda, K. (2011) Science, 331, 337–341.
6) Ichinohe, T., Pang, I.K., Kumamoto, Y., Peaper, D.R., Ho, J.H., Murray, T.S., & Iwasaki, A. (2011) Proc. Natl. Acad. Sci. USA, 108, 5354–5359.
7) Abt, M.C., Osborne, L.C., Monticelli, L.A., Doering, T.A., Alenghat, T., Sonnenberg, G.F., Paley, M.A., Antenus, M., Williams, K.L., Erikson, J., Wherry, E.J., & Artis, D. (2012) Immunity, 37, 158–170.
8) Boissiere, A., Tchioffo, M.T., Bachar, D., Abate, L., Marie, A., Nsango, S.E., Shahbazkia, H.R., Awono-Ambene, P.H., Levanshina, E.A., Christen, R., & Morlais, I. (2012) PLoS Pathog., 8, e1002742.
9) Bando, H., Okado, K., Guelbeogo, W.M., Badolo, A., Aonuma, H., Nelson, B., Fukumoto, S., Xuan, X., Sagnon, N., & Kanuka, H. (2013) Sci. Rep., 3, 1641.
10) Gendrin, M., Fodgers, R.H., Yerbanga, R.S., Ouedraogo, J.B., Basanez, M.-G., Cohuet, A., & Christophides, G.K. (2014) Nat. Commun., 6, 5921.
11) Yilmaz, B., Portugal, S., Tran, T.M., Gozzelino, R., Ramos, S., Gomes, J., Regalado, A., Cowan, P.J., d’Apice, A.J.F., Chong, A.S., Doumbo, O.K., Traore, B., Crompton, P.D., Siveira, H., & Soares, M.P. (2014) Cell, 159, 1277–1289.
12) Yooseph, S., Kirkness, E.F., Tran, T.M., Harkins, D.M., Jones, M.B., Torralba, M.G., O’Connell, E., Nutman, T.B., Doumbo, S., Doumbo, O.K., Traore, B., Crompton, P.D., & Nelson, K.E. (2015) BMC Genomics, 16, 631.
13) Villarino, N.F., LeCleir, G.R., Denny, J.E., Dearth, S.P., Harding, C.L., Sloan, S.S., Gribble, J.L., Campagna, S.R., Wilhelm, S.W., & Schmidt, N.W. (2016) Proc. Natl. Acad. Sci. USA, 113, 2235–2240.
14) Taniguchi, T., Miyauchi, E., Nakamura, S., Hirai, M., Suzue, K., Imai, T., Nomura, T., Handa, T., Okada, H., Shimokawa, C., Onishi, R., Olia, A., Hirata, J., Tomita, H., Ohno, H., Horii, T., & Hisaeda, H. (2015) Sci. Rep., 5, 1038.
15) Mooney, J.P., Lokken, K.L., Byndloss, M.X., George, M.D., Valazquez, E.M., Faber, F., Butler, B.P., Walker, G.T., Ali, M.M., Potts, R., Tiffany, C., Ahmer, B.M.M., Luckhart, S., & Tsolis, R.M. (2015) Sci. Rep., 5, 14603.