2) Sun, Y.G., Zhao, Z.Q., Meng, X.L., Yin, J., Liu, X.Y., & Chen, Z.F. (2009) Science, 325, 1531–1534.
5) Ross, S.E., Mardinly, A.R., McCord, A.E., Zurawski, J., Cohen, S., Jung, C., Hu, L., Mok, S.I., Shah, A., Savner, E.M., Tolias, C., Corfas, R., Chen, S., Inquimbert, P., Xu, Y., McInnes, R.R., Rice, F.L., Corfas, G., Ma, Q., Woolf, C.J., & Greenberg, M.E. (2010) Neuron, 65, 886–898.
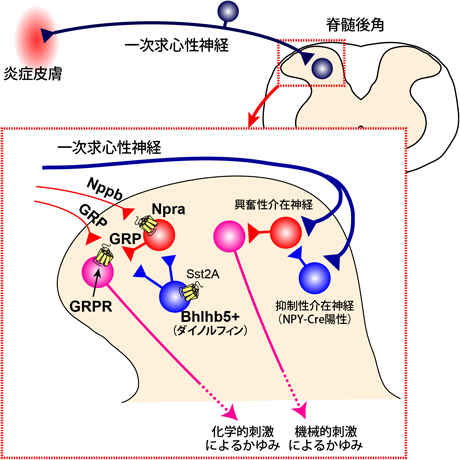
6) Kardon, A.P., Polgar, E., Hachisuka, J., Snyder, L.M., Cameron, D., Savage, S., Cai, X., Karnup, S., Fan, C.R., Hemenway, G.M., Bernard, C.S., Schwartz, E.S., Nagase, H., Schwarzer, C., Watanabe, M., Furuta, T., Kaneko, T., Koerber, H.R., Todd, A.J., & Ross, S.E. (2014) Neuron, 82, 573–586.
7) Bourane, S., Duan, B., Koch, S.C., Dalet, A., Britz, O., Garcia-Campmany, L., Kim, E., Cheng, L., Ghosh, A., Ma, Q., & Goulding, M. (2015) Science, 350, 550–554.
8) Matsuda, H., Watanabe, N., Geba, G.P., Sperl, J., Tsudzuki, M., Hiroi, J., Matsumoto, M., Ushio, H., Saito, S., Askenase, P.W., & Ra, C. (1997) Int. Immunol., 9, 461–466.
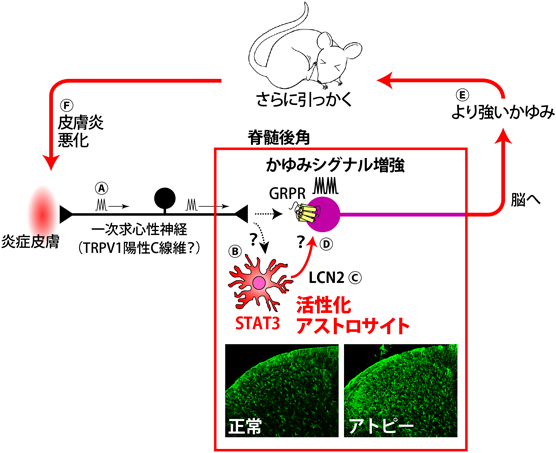
9) Shiratori-Hayashi, M., Koga, K., Tozaki-Saitoh, H., Kohro, Y., Toyonaga, H., Yamaguchi, C., Hasegawa, A., Nakahara, T., Hachisuka, J., Akira, S., Okano, H., Furue, M., Inoue, K., & Tsuda, M. (2015) Nat. Med., 21, 927–931.
11) Liu, T., Han, Q., Chen, G., Huang, Y., Zhao, L.X., Berta, T., Gao, Y.J., & Ji, R.R. (2016) Pain, 157, 806–817.
12) Jha, M.K., Lee, S., Park, D.H., Kook, H., Park, K.G., Lee, I.K., & Suk, K. (2015) Neurosci. Biobehav. Rev., 49, 135–156.
13) Kohro, Y., Sakaguchi, E., Tashima, R., Tozaki-Saitoh, H., Okano, H., Inoue, K., & Tsuda, M. (2015) Sci. Rep., 5, 14306.