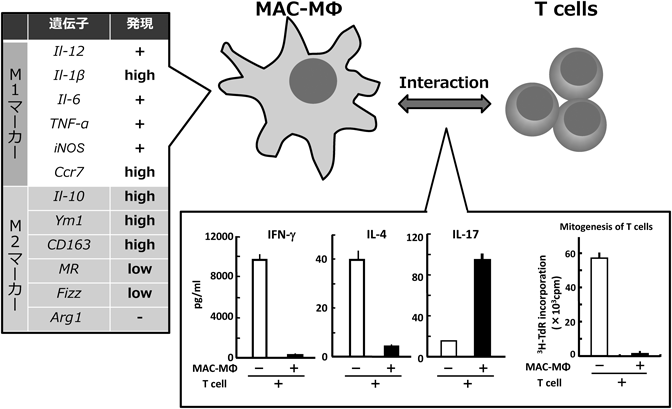
Mycobacterium avium complexの感染で誘導されるユニークなマクロファージによるT細胞の分化活性化の制御Unique macrophages induced by infection with Mycobacterium avium complex regulate the mitogenesis and differentiation of T cells
1 国際医療福祉大学薬学科生体防御学分野Division of Immunobiology, Department of Pharmaceutical Sciences, International University of Health and Welfare ◇ 〒324–8501 栃木県大田原市北金丸2600–1 ◇ 2600–1 Kitakanemaru, Ohtawara, Tochigi 324–8501, Japan
2 安田女子大学看護学科・児童教育学科Department of Basic Medical Sciences for Nursing, Yasuda Women’s University ◇ 〒731–0153 広島市安佐南区安東6–13–1 ◇ 6–13–1 Yasuhigashi, Asaminami-ku, Hiroshima 731–0153, Japan
3 島根大学医学科Department of Microbiology and Immunology, Shimane University School of Medicine ◇ 〒693–8501 島根県出雲市塩治町89–1 ◇ 89–1 Enyacho, Izumo, Shimane 693–8501, Japan