緑色蛍光タンパク質(GFP)の開発を契機に,蛍光イメージングは生物医学研究で広く利用されるようになった.蛍光は,光照射によって励起された電子が基底状態に戻る際に発する光であるため,励起光を必要とする.多くの場合,励起光の強度は得られる蛍光の1万倍にも達し,蛍光顕微鏡で細胞を観察する際に照射する励起光のエネルギー密度は直射日光に匹敵する.そのため,この強力な励起光照射の副作用として,光毒性や自家蛍光といった問題が生じる1).また,近年,光遺伝学など光刺激によるタンパク質・細胞機能操作のツールの開発が進められているが,これらのツールを利用する際には,観察用の励起光でツールが誤作動しないよう注意する必要がある.さらに,個体でのin vivoイメージングなど深部イメージングの際には,励起光を組織深部まで到達させる必要があるが,一般に励起光は蛍光よりも短波長であるため組織中で散乱の影響を受けやすく,深部に到達させることが困難である.
これらの問題を回避するために,二光子励起蛍光顕微鏡や近赤外蛍光プローブなど近赤外光を利用した蛍光顕微鏡法が開発されているが,酵素反応のエネルギーで電子を励起して発光する生物発光を利用することができれば,励起光に起因する諸問題は解決される.実際,ホタルやウミシイタケなどに由来する発光酵素ルシフェラーゼを用いた個体レベルのin vivoイメージングはすでに広く行われている.また,自家蛍光がなく低バックグラウンドで定量性が高いことを利用した転写活性の定量的評価なども日常的に行われている.
しかし,これらのルシフェラーゼの発光強度は,蛍光イメージングにおける蛍光強度の1/1000以下と文字どおり桁違いに暗く,イメージングの際には分単位の露光が必要であった.また,発光色も限られており,高い時間・空間解像度でのマルチカラーイメージングは困難であった.
下村らによるGFP発見の経緯2)が端的に示しているように,天然にはルシフェラーゼと蛍光タンパク質が複合体を形成し,共鳴エネルギー移動によって発光効率の向上と発光色の長波長化を行っている例が少なくない.ウミシイタケもその例の一つである3).大阪大学の永井健治らは,これに着目し,ウミシイタケのルシフェラーゼ(RLuc)と黄色蛍光タンパク質Venusを至適化されたリンカー配列を介した融合タンパク質とすることで黄緑色に明るく発光する生物発光プローブを開発し,Nano-lanternと名づけた4).RLucへの変異導入による高活性化,共鳴エネルギー移動による発光効率向上,融合タンパク質化によるRLucタンパク質の細胞内での安定化などの効果によって,野生型RLucに比べて精製タンパク質で約10倍,発現細胞では約100倍の発光強度が達成され,ビデオレートでのin vivo発光イメージングが実現された.
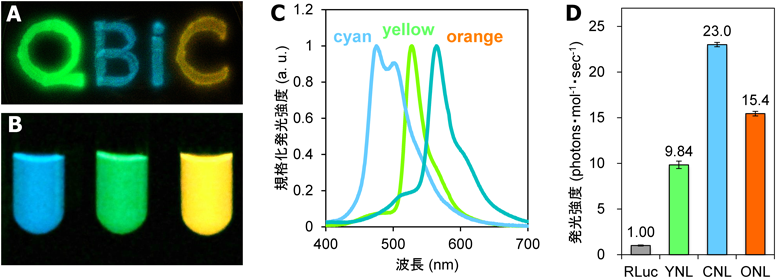
我々は,脊椎動物初期発生における遺伝子発現動態・シグナル伝達動態のライブイメージングのための基盤技術として,このNano-lanternに着目し,永井健治研究室と共同でNano-lanternの多色化に取り組んだ.共鳴エネルギー移動を利用している点に注目し,アクセプターとなる蛍光タンパク質を変更し,高効率で発光するものをスクリーニングすることで,シアンおよびオレンジのNano-lanternの開発に成功し5)(図1),遺伝子発現動態・シグナル伝達動態のライブイメージングへの応用を行っている.
本稿では,培養動物細胞への応用を中心に,Nano-lanternを用いた発光イメージングの技術的詳細について紹介する.
培養細胞の発光イメージング専用の顕微鏡システムとして,オリンパス社からLV200が市販されている.遮光性能の高い暗箱,高感度なEM-CCDカメラ,機械式の倒立顕微鏡を組み合わせた装置で,長時間露光が必要な従来の発光イメージングにも十分対応できる優れたシステムである.この装置でNano-lantern発現細胞をみると非常に明るいので,ほぼビデオレートで発光細胞を探して合焦することができて便利である.
しかし,このような専用機は必須ではない.蛍光とは異なり,励起用の光学系は不要なので,むしろ蛍光顕微鏡よりも単純な装置でよい.
まず重要なのが,高感度カメラである.最近,sCMOSカメラの性能向上が著しいが,1ピクセルあたり2~3光子以下の暗い試料では,まだEM-CCDの方が優れている.したがって,発光イメージングでは,EM-CCDの利用が望ましい.我々は主に,Andor社のiXon3 897 EM-CCDカメラを使用しているが,他社製品でも問題ない.たとえば,浜松ホトニクス社のImagEM X2 EM-CCDカメラは,フォトンイメージングモードなど発光イメージングでの使用に便利な画像処理を内蔵しているため使いやすい.
顕微鏡は,単純な顕微鏡で十分である.一部の電動顕微鏡は,装置内部の基盤上にパイロットランプなど光源があり,これが観察光路に迷い込んで背景光となるので注意を要する.対物レンズは,PlanApoなどレンズ枚数の多い高級対物レンズの必要はなく,集光効率が高く(=NAが高い),透過率の高いものを選ぶとよい.我々は,UApo40XO NA1.35(オリンパス社)を愛用している.ダイクロイックミラーは不要である.マルチカラーイメージングでなければ,蛍光フィルタは一切不要である.マルチカラーイメージングの際も,CFP, YFP, OFP用のバリアフィルタだけを用いればよい.我々は,Semrock社のフィルタをEM-CCDカメラの前につけたフィルターホイールにセットしている.
重要なのは,遮光環境である.部屋を暗くするだけでは,PCの画面などの灯りが背景光となってしまう.撮影の際にすべてオフにしてしまうのは不便である.我々は,見栄えは悪いが,顕微鏡の周りをアルミ箔でグルグル覆って遮光している(図2).倒立顕微鏡の場合,ステージ上の試料の上からの迷光が問題となるのは当然だが,ステージの下側から対物レンズの方に回り込む光も意外に無視できない.試料の上に暗箱を被せるのに加えて,ステージの周囲にスカートのようにアルミ箔を垂らすのが効果的である.
cyan, yellow, orange各色のNano-Lanternおよび,細胞内小器官などへの局在化シグナルとの融合タンパク質を発現するプラスミドは,理研DNAバンクおよびAddgeneから配布されている.初めて試すならば,Histone H2Bとの融合タンパク質で核(染色体)を染めるのが明るくて見やすいだろう(AddgeneのIDは65702-65704,理研DNAバンクのIDはRDB13362-RDB13364).
蛍光タンパク質の場合は,発現ベクターを細胞に導入するだけで観察可能になるが,ルシフェラーゼには発光基質が必要である.Nano-lanternは,RLucをルシフェラーゼとして用いているので,発光基質としてはセレンテラジンを用いる.和光純薬社のセレンテラジンh(035-22991)が比較的安価である.100 mM DMSO溶液で酸化を防ぐため窒素雰囲気下で遮光,-80°C保存している.観察直前に培地に添加する(終濃度10~60 µM).
セレンテラジンhは,血清中のBSAなどと結合して酸化され,発光する.これを防ぎ,観察時間を長くするため,我々は誘導体のジアセチルセレンテラジンhを合成して使用している5).
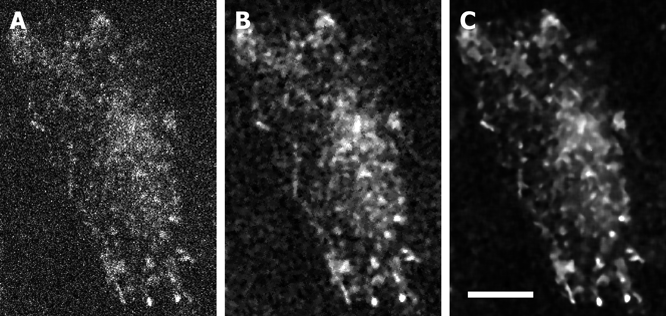
Nano-lanternはRLucなどより10~20倍高輝度化されているものの,Nano-lantern発現細胞からの発光シグナルは,通常の蛍光ライブセルイメージングに比べると1/10以下である.それでも,蛍光イメージングと異なり,自家蛍光などの影響がなく背景が真っ暗であるため,信号としては十分に検出できる.しかし,光子数が少ないため,光子数の平方根に比例するショットノイズの影響が無視できない.長時間露光を行って光子数を稼げば解決するが,時間分解能が犠牲となり,動いている試料の観察が困難となる.
したがって,画像処理によるノイズ軽減が有効である(図3).簡単には,メディアン処理を行うとよい.より高度なノイズ軽減画像処理として,たとえばSafirフィルタがある.Image Jのプラグインなどフリーウェア版に加え,Roper社からMetaMorph用に市販されている.
蛍光タンパク質のマルチカラーイメージングの場合は,励起スペクトルの違いと蛍光スペクトルの違いの両方を利用することで,異なる色の蛍光タンパク質の信号を選択性高く取得することが可能である.しかし,Nano-lanternの場合は,発光スペクトルの違いによる分離しかできない.図1A~Cにあるとおり,肉眼でみるとcyan, yellow, orangeのNano-lanternは明らかに色が異なるが,スペクトルは大きく重なっており,単純にバンドパスフィルタを挿入するだけでは三つのシグナルを分離することはできない.
そこで,計算によってシグナルの分離を行う.原理は以下のとおりである.cyan, yellow, orangeのNano-lanternの発光強度をx, y, zとし,460~510 nm, 495~540 nm, 540 nm以上のフィルタを使って撮影した結果をそれぞれU, V, Wとすると,cyan, yellow, orangeの信号がそれぞれのフィルタで何パーセント通過するかによって, のように,表すことができる.ここで,a1, a2, ..., c3は,通過率に相当するパラメータである.最初にcyan, yellow, orangeそれぞれ単独に発現している細胞でU, V, Wを測定することで,a1, a2, ..., c3を測定すれば,あとはこの式を逆算することで測定値U, V, Wから各色の信号x, y, zを求めることができる5).
実際の処理は,Image JのSpectral Unmixingや,MetaMorph関連ではPrizMageなどのソフトウェアを使うのが簡便である.
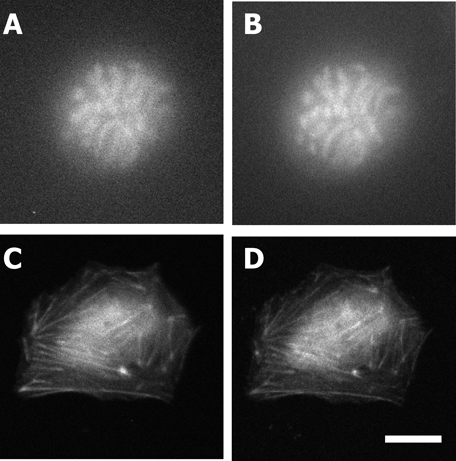
図4に,細胞内微細構造の発光イメージングの作例を示す.露光時間は1秒程度と,蛍光の10~30倍かかるが,蛍光イメージングに匹敵する画像が得られている.ただし,図4A, Cでも細胞中央付近で顕著だが,発光イメージングでは厚さ方向の重なりが多い部分が不鮮明である.蛍光では,励起光を焦点に集める効果によって,焦点面の蛍光分子が強く光るが,発光では試料内プローブ分子のすべてが同じように光る.したがって,発光イメージングでは,焦点面の前後からの信号の影響を強く受けてしまう.
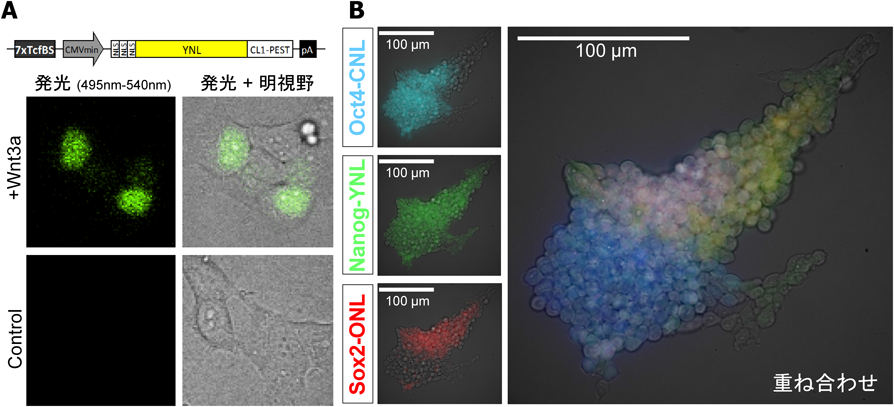
図5は,遺伝子発現のレポーターとしての応用例である.従来のホタルのルシフェラーゼとは異なり,1秒以下の露光時間で遺伝子発現を1細胞レベルで検出することが可能となった(図5A).また,3色のNano-lanternを使用することで,三つの遺伝子発現を同時に解析することが可能となった(図5B).
これまで,発光イメージングは信号強度がきわめて微弱であったため,ごく限られた研究者だけが利用する特殊な実験手法であった.Nano-lanternの開発により,発光イメージングの応用範囲は大きく拡がり,蛍光イメージングの欠点を補完する実験手法として普及することが期待される.紙数の関係で紹介できなかったが,Nano-lanternを利用した細胞内シグナル伝達のバイオセンサーなども開発されており4, 5),発光を利用した細胞・個体レベルのイメージングへと発展が期待される.
本稿で詳述したとおり,発光イメージングには特別な装置はほとんど必要なく,蛍光イメージングに使用している機器が流用できる.本稿が,発光イメージングに着手する契機になれば幸甚である.
謝辞Acknowledgments
本研究は,大阪大学永井健治研究室,理研生命システム研究センター(QBiC)渡邊朋信研究室,神隆研究室との共同研究の成果であり,ここに感謝の意を表します.
引用文献References
1) Magidson, V. & Khodjakov, A. (2013) Methods Cell Biol., 114, 545–560.
2) Shimomura, O. (2005) J. Microsc., 217, 1–15.
3) Ward, W.W. & Cormier, M.J. (1976) J. Phys. Chem., 80, 2289–2291.
4) Saito, K., Chang, Y.F., Horikawa, K., Hatsugai, N., Higuchi, Y., Hashida, M., Yoshida, Y., Matsuda, T., Arai, Y., & Nagai, T. (2012) Nat. Commun., 3, 1262.
5) Takai, A., Nakano, M., Saito, K., Haruno, R., Watanabe, T.M., Ohyanagi, T., Jin, T., Okada, Y., & Nagai, T. (2015) Proc. Natl. Acad. Sci. USA, 112, 4352–4356.
著者紹介Author Profile
 高井 啓(たかい あきら)
高井 啓(たかい あきら)理化学研究所生命システム研究センター細胞動態計測コア細胞極性統御研究チーム基礎科学特別研究員.博士(医学).
略歴2003年北海道大学農学部卒業,05年同大学大学院農学研究科修士課程修了,09年京都大学大学院医学研究科博士課程単位取得認定退学後,理研発生・再生科学総合研究センターリサーチアソシエイトを経て12年より現所属特別研究員.15年より現職.
研究テーマと抱負細胞外マトリクス研究,ツメガエル発生研究を経て,プローブ開発をしています.興味は細胞外シグナルを介した個体発生・細胞分化の仕組みであり,ゆくゆくはプローブ開発を通じてその仕組みを解明していきたいです.
趣味サッカー・フットサル,ビール・地ビール・輸入ビール.
 岡田 康志(おかだ やすし)
岡田 康志(おかだ やすし)理化学研究所生命システム研究センター細胞動態計測コア細胞極性統御研究チームチームリーダー.博士(医学).
略歴1993年東京大学医学部卒業,医籍登録.94年日本学術振興会特別研究員,95年東京大学医学部解剖学・細胞生物学教室助手を経て2011年より現職.16年より東京大学大学院理学系研究科物理学教室教授を兼務.
研究テーマと抱負細胞内物質輸送の研究を原点として,生命機能が営まれている現場を一分子レベルで直接見て,操作して,理解することを目指して,必要な技術開発から応用研究まで幅広く展開しています.
ウェブサイトhttp://www.qbic.riken.jp/japanese/research/outline/lab-07.html