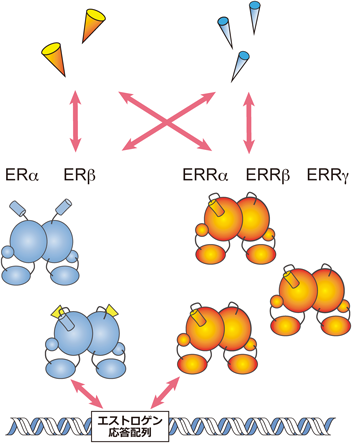
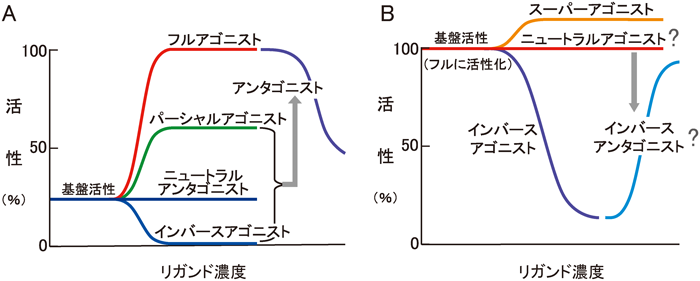
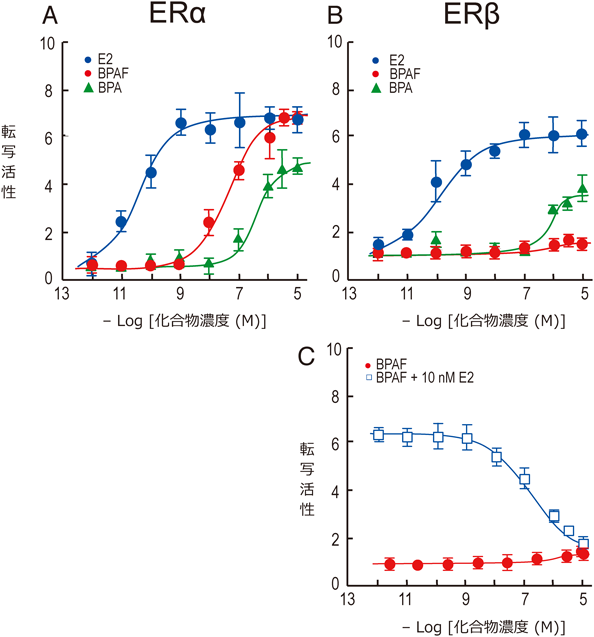
前述のように,ビスフェノールAがエストロゲン様活性を示すことは古くから知られていた.そのため,ビスフェノールAの作用標的はエストロゲン受容体であると理解されてきた.エストロゲンやアンドロゲンなどのステロイドホルモンに応答する核内受容体は,NR3ファミリーに属しており,合計9種類存在する(表1).これらのなかでも,エストロゲンの受容体であるERαおよびERβ,この二つとよく似ているがエストロゲンが結合しないエストロゲン関連受容体α型(ERRα),β型(ERRβ),γ型(ERRγ)の5種は,多くの組織や細胞で共存することも多く,また,これらすべての受容体が,DNA上の標的であるエストロゲン応答配列に結合できることから,クロストークする可能性が指摘されている(図1)50, 51).ERRα, ERRβ, ERRγはすべてリガンド未知の核内受容体であり,リガンドなしの状態で100%の活性を示す自発活性化型核内受容体である.通常実験に用いられるERαと比較すると,DBDはいずれも85%の類似性を持ち非常によく似ているのに対し,LBDではERRα, ERRβ, ERRγの順に66%, 69%, 74%の類似性であり,わずかながら差がある(図2).そこで,まずはERαに一番よく似ているERRγについて,網羅的に各種リガンドのスクリーニングを行った.この試験系の構築にあたっては,当時,乳がんの治療薬として使われるタモキシフェンの活性型代謝物,すなわち4-ヒドロキシタモキシフェン(4-OHT)がERRγに結合することが報告されたばかりであった52).そこで,このトリチウム標識化合物をトレーサーとして用いた放射リガンド競合結合試験により化合物スクリーニングを実施した.その結果,ビスフェノールAが内在性ホルモンに匹敵するほどに非常に強く結合することを明らかにした53).さらに,この結合試験の結果を受けて,ERRγのレポーター遺伝子アッセイによる転写活性化試験系を構築し,ビスフェノールAがERRγの転写活性に与える影響を評価した.これだけ強く結合するのだから,当然,何らかの活性変化がみられると期待した.しかし,意外なことに,自発活性化型核内受容体であるERRγが初めから示す転写活性に対して,ビスフェノールAの結合はそれをさらに活性化することも抑制することもなく,まったく変化がみられなかった.ここで,本当にビスフェノールAは,ERRγの活性制御に関わるリガンド結合ドメインに結合しているのか?という疑問が生じた.そこで,さらに活性試験系を改良した.4-OHTはERRγが初めから示す高い転写活性を抑制する阻害剤として知られていた.4-OHTを添加した後に,ビスフェノールAを加えれば,リガンド結合ドメインにおけるこれらの競合が起き,活性に変化がみられるはずである.結果として,4-OHTにより抑制された活性は,ビスフェノールAの添加により回復することを証明できた.ところで,研究の歴史の長いGタンパク質共役型受容体(GPCR)研究では,受容体に結合し,GPCRがもともと持つ構成的活性,すなわち基盤活性を変化させないリガンドはニュートラルアンタゴニストと呼ばれる(図3)54).では,ERRγのように初めから活性構造をとり,100%の構成的活性を持っている場合,この基盤活性を変化させないリガンドは何と呼ぶのが適切であろうか? ニュートラルアンタゴニストに対応する言葉として,ニュートラルアゴニストといえるかもしれない.また,インバースアゴニストの阻害剤なので,インバースアンタゴニストといえるかもしれない.いずれにしろ,核内受容体にはリガンド依存的に活性を発揮する,リガンド依存型核内受容体と,初めから高い構成活性を持つ自発活性化型核内受容体が存在することが特徴的であり,これらの活性化機構は区別して考える必要がある.
さらに,トリチウム標識されたビスフェノールAを用いて,ERRγとの直接の結合試験を実施した.その飽和結合試験の結果,解離定数Kd値5.50 nMという非常に強い結合を示す結果が得られた55, 56).一方で,ビスフェノールAがERRαとERRβにはまったく結合しないことが判明した.さらに,さまざまな核内受容体に対する網羅的な結合試験の結果,ビスフェノールAは,生体に対する異物の代謝に関わりP450を誘導するCARのアイソフォームにも非常に強く結合することを明らかにした.これまでに,複数あるCARのアイソフォームのうち,ビスフェノールAはCAR1とCAR2の二つの転写活性を誘導することが報告されている57).この他にも,BPAがRXRの転写活性化に働くことが報告されたが58),筆者らも同様の知見を得ている.
ビスフェノールAFはビスフェノールAのフェニル基をつなぐ炭素上にある二つのメチル基の水素原子をすべてフッ素原子に置き換えた化合物である.近年,このようにハロゲン原子を含むリガンドと,受容体タンパク質の間における,ハロゲン原子を介した結合が注目されている70–75).これは「ハロゲン結合」と呼ばれる弱い非共有結合である.ルイス酸であるハロゲン原子とルイス塩基の間の相互作用であり,ハロゲンが求電子的に働くときに形成される.タンパク質などの生体分子中では,タンパク質の酸素原子とリガンドのハロゲン原子の間に形成される場合が多く,ちょうどハロゲン結合は水素結合に対応する形をとる(図7).そもそもハロゲン原子を介した結合は,小分子では古くから知られていた.筆者は,ハロゲン原子の特有の性質を活かして,リガンド–受容体相互作用探索子として含フッ素フェニルアラニンをペプチドリガンドに系統的に導入した研究プロジェクトに従事してきた経験があるが76–78),タンパク質のような巨大分子におけるハロゲン結合が注目されるようになったのは1990年代に入ってからのことである.これは,ひとえにタンパク質のX線結晶構造解析の構造データの蓄積の恩恵によるところが大きい.現在では120,000を超えるタンパク質のX線結晶構造解析データとNMRによる構造解析データなどがProtein Data Bank (PDB)に報告されている79).なお,小分子の結晶構造データベースであるケンブリッジ構造データベースには800,000を超える化合物が登録されている80).
新世代ビスフェノールの中で,ハロゲン原子を含むものはビスフェノールAFの他にも存在する(図8).特に塩素原子を含む化合物が多く,プラスチック原料としては4-[2,2-dichloro-1-(4-hydroxyphenyl)vinyl]phenol(BPC)81)がある.またまた難燃剤では2,2-bis(3,5-dibromo-4-hydroxyphenyl)propane(tetrabromobisphenol A:TBBPA)や2,2-bis(3,5-dichloro-4-hydroxyphenyl)propane(tetrachlorobisphenol A;TCBPA)82)がある.さらに,かつて使われた殺虫剤メトキシクロル(methxychlor)の代謝物である2-bis(p-hydroxyphenyl)-1,1,1-trichloroethane (HPTE)も塩素原子塩素原子を含むビスフェノール誘導体である83).また,農薬としてかつて日本でも広く使用された2,2-bis(p-chlorophenyl)-1,1,1-trichloroethane(DDT)84)の代謝物である2,2-bis(p-chlorophenyl)-1,1-dichloroethylene(DDE)はヒドロキシ基(OH)がクロロ基(Cl)になっているため,ビスフェノール骨格とそのものではないものの,よく似た構造をしている85).フェノール骨格とハロゲンを含有するという観点でいえば,甲状腺ホルモンのトリヨードチロニン(T3)は,甲状腺ホルモン受容体の内在リガンドである86, 87).より強いリガンドを作るという創薬を目指す観点からも,ハロゲン原子を含む化合物と受容体との相互作用について,ますますの研究発展が期待されている.
引用文献References
1) Helsen, C. & Claessens, F. (2014) Mol. Cell. Endocrinol., 382, 97–106.
2) Gao, J. & Xie, W. (2012) Trends Pharmacol. Sci., 33, 552–558.
3) Sekiya, T., Kashiwagi, I., Yoshida, R., Fukaya, T., Morita, R., Kimura, A., Ichinose, H., Metzger, D., Chambon, P., & Yoshimura, A. (2013) Nat. Immunol., 14, 230–237.
4) Parent, A.S., Franssen, D., Fudvoye, J., Gérard, A., & Bourguignon, J.P. (2015) Front. Neuroendocrinol., 38, 12–36.
5) vom Saal, F.S. & Hughes, C. (2005) Environ. Health Perspect., 113, 926–933.
6) Huss, J.M., Garbacz, W.G., & Xie, W. (2015) Biochim. Biophys. Acta, 1852, 1912–1927.
7) King-Jones, K. & Thummel, C.S. (2005) Nat. Rev. Genet., 6, 311–323.
8) Maglich, J. M., Sluder, A., Guan, X., Shi, Y., McKee, D. D., Carrick, K., Kamdar, K., Willson, T. M., & Moore, J. T. (2001) Genome Biol., 2, research0029.1–research0029.7.
9) Antebi, A. (2015) WormBook, The C. elegans Research Community ed., doi/10.1895/wormbook.1.64.2, 1–49.
10) Baker, M.E. (2011) Mol. Cell. Endocrinol., 334, 14–20.
11) Bertrand, S., Belgacem, M.R., & Escriva, H. (2011) Mol. Cell. Endocrinol., 334, 67–75.
12) Lecroisey, C., Laudet, V., & Schubert, M. (2012) Brief. Funct. Genomics, 11, 156–166.
13) Schubert, M., Brunet, F., Paris, M., Bertrand, S., Benoit, G., & Laudet, V. (2008) Dev. Genes Evol., 218, 651–665.
14) Antebi, A. (2006) WormBook, doi/10.1895/wormbook.1.64.1, 1–13.
15) Enmark, E. & Gustafsson, J.A. (2001) Trends Pharmacol. Sci., 22, 611–615.
16) Robinson-Rechavi, M., Maina, C.V., Gissendanner, C.R., Laudet, V., & Sluder, A. (2005) J. Mol. Evol., 60, 577–586.
17) Robinson-Rechavi, M., Carpentier, A.S., Duffraisse, M., & Laudet, V. (2001) Trends Genet., 17, 554–556.
18) Committee, N.R.N. (1999) Cell, 97, 161–163.
19) Otte, K., Kranz, H., Kober, I., Thompson, P., Hoefer, M., Haubold, B., Remmel, B., Voss, H., Kaiser, C., Albers, M., Cheruvallath, Z., Jackson, D., Casari, G., Koegl, M., Pääbo, S., Mous, J., Kremoser, C., & Deuschle, U. (2003) Mol. Cell. Biol., 23, 864–872.
20) Zhang, Z., Burch, P.E., Cooney, A.J., Lanz, R.B., Pereira, F.A., Wu, J., Gibbs, R.A., Weinstock, G., & Wheeler, D.A. (2004) Genome Res., 14, 580–590.
21) Pfisterer, U., Kirkeby, A., Torper, O., Wood, J., Nelander, J., Dufour, A., Björklund, A., Lindvall, O., Jakobsson, J., & Parmar, M. (2011) Proc. Natl. Acad. Sci. USA, 108, 10343–10348.
22) Caiazzo, M., Dell’Anno, M.T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., Sotnikova, T.D., Menegon, A., Roncaglia, P., Colciago, G., Russo, G., Carninci, P., Pezzoli, G., Gainetdinov, R.R., Gustincich, S., Dityatev, A., & Broccoli, V. (2011) Nature, 476, 224–227.
23) Benod, C., Villagomez, R., & Webb, P. (2016) J. Steroid Biochem. Mol. Biol., 157, 41–47.
24) Latchman, D.S. (2005) Gene Control, 2nd Ed., Garland Science.
25) Calo, E. & Wysocka, J. (2013) Mol. Cell, 49, 825–837.
26) Evans, R.M. & Mangelsdorf, D.J. (2014) Cell, 157, 255–266.
27) Deblois, G. & Giguère, V. (2013) Nat. Rev. Cancer, 13, 27–36.
28) Dodds, E.C. & Lawson, W. (1936) Nature, 137, 996–996.
29) https://ntp.niehs.nih.gov/ntp/ohat/bisphenol/bisphenol.pdf
30) Krishnan, A.V., Stathis, P., Permuth, S.F., Tokes, L., & Feldman, D. (1993) Endocrinology, 132, 2279–2286.
31) Alonso-Magdalena, P., Ropero, A.B., Soriano, S., García-Arévalo, M., Ripoll, C., Fuentes, E., Quesada, I., & Nadal, Á. (2012) Mol. Cell. Endocrinol., 355, 201–207.
32) Fang, H., Tong, W., Perkins, R., Soto, A.M., Prechtl, N.V., & Sheehan, D.M. (2000) Environ. Health Perspect., 108, 723–729.
33) Anderson, O.S., Peterson, K.E., Sanchez, B.N., Zhang, Z., Mancuso, P., & Dolinoy, D.C. (2013) FASEB J., 27, 1787–1792.
34) Carmona-Alcocer, V., Fuentes-Granados, C., Carmona-Castro, A., Aguilar-González, I., Cárdenas-Vázquez, R., & Miranda-Anaya, M. (2012) Physiol. Behav., 105, 727–733.
35) Batista, T.M., Alonso-Magdalena, P., Vieira, E., Amaral, M.E.C., Cederroth, C.R., Nef, S., Quesada, I., Carneiro, E.M., & Nadal, A. (2012) PLoS ONE, 7, e33814.
36) Rönn, M., Kullberg, J., Karlsson, H., Berglund, J., Malmberg, F., Orberg, J., Lind, L., Ahlström, H., & Lind, P.M. (2013) Toxicology, 303, 125–132.
37) Ishido, M., Masuo, Y., Terasaki, M., & Morita, M. (2011) Toxicol. Lett., 206, 300–305.
38) Ishido, M., Masuo, Y., Kunimoto, M., Oka, S., & Morita, M. (2004) J. Neurosci. Res., 76, 423–433.
39) Wolstenholme, J.T., Edwards, M., Shetty, S.R.J., Gatewood, J.D., Taylor, J.A., Rissman, E.F., & Connelly, J.J. (2012) Endocrinology, 1–11.【153, 3828–3838?】
40) Xu, X.-B., He, Y., Song, C., Ke, X., Fan, S.-J., Peng, W.-J., Tan, R., Kawata, M., Matsuda, K.-I., Pan, B.-X., & Kato, N. (2014) Hippocampus, 24, 1570–1580.
41) Matsushima, A., Ryan, K., Shimohigashi, Y., & Meinertzhagen, I.A. (2013) Environ. Pollut., 173, 257–263.
42) http://healthycanadians.gc.ca/healthy-living-vie-saine/infant-care-soins-bebe/bottles-biberons-eng.php?_ga=1.206751123.140193388.1471922442
43) https://www.anses.fr/en/content/frances-proposal-restriction-bisphenol-use-thermal-paper-prepared-anses-submitted-public
44) Panel, E.C. (2015) EFSA J., 13, 3978.
45) http://www.mhlw.go.jp/topics/bukyoku/iyaku/kigu/topics/080707-1.html
46) http://www.nihs.go.jp/edc/edc.html
47) http://www.env.go.jp/chemi/end/attach/extend2016.pdf#search=‘化学物質の内分泌かく乱作用に関する今後の対応’
48) Bucher, J.R. (2009) Environ. Health Perspect., 117, A96–A97.
49) Heindel, J.J., Newbold, R.R., Bucher, J.R., Camacho, L., Delclos, K.B., Lewis, S.M., Vanlandingham, M., Churchwell, M.I., Twaddle, N.C., McLellen, M., Chidambaram, M., Bryant, M., Woodling, K., Costa, G.G., Ferguson, S.A., Flaws, J., Howard, P.C., Walker, N.J., Zoeller, R.T., Fostel, J., Favaro, C., & Schug, T.T. (2015) Reprod. Toxicol., 58, 33–44.
50) Giguère, V. (2002) Trends Endocrinol. Metab., 13, 220–225.
51) Takeda, Y., Liu, X., Sumiyoshi, M., Matsushima, A., Shimohigashi, M., & Shimohigashi, Y. (2009) J. Biochem., 146, 113–122.
52) Coward, P., Lee, D., Hull, M.V., & Lehmann, J.M. (2001) Proc. Natl. Acad. Sci. USA, 98, 8880–8884.
53) Takayanagi, S., Tokunaga, T., Liu, X., Okada, H., Matsushima, A., & Shimohigashi, Y. (2006) Toxicol. Lett., 167, 95–105.
54) Tate, C.G. (2012) Trends Biochem. Sci., 37, 343–352.
55) Okada, H., Tokunaga, T., Liu, X., Takayanagi, S., Matsushima, A., & Shimohigashi, Y. (2008) Environ. Health Perspect., 116, 32–38.
56) Liu, X., Matsushima, A., Okada, H., Tokunaga, T., Isozaki, K., & Shimohigashi, Y. (2007) FEBS J., 274, 6340–6351.
57) DeKeyser, J.G., Laurenzana, E.M., Peterson, E.C., Chen, T., & Omiecinski, C.J. (2011) Toxicol. Sci., 120, 381–391.
58) Sui, Y., Ai, N., Park, S.-H., Rios-Pilier, J., Perkins, J.T., Welsh, W.J., & Zhou, C. (2012) Environ. Health Perspect., 120, 399–405.
59) Matsushima, A., Kakuta, Y., Teramoto, T., Koshiba, T., Liu, X., Okada, H., Tokunaga, T., Kawabata, S.-I., Kimura, M., & Shimohigashi, Y. (2007) J. Biochem., 142, 517–524.
60) Kallen, J., Schlaeppi, J.-M., Bitsch, F., Filipuzzi, I., Schilb, A., Riou, V., Graham, A., Strauss, A., Geiser, M., & Fournier, B. (2004) J. Biol. Chem., 279, 49330–49337.
61) Liu, X., Matsushima, A., Okada, H., & Shimohigashi, Y. (2010) J. Biochem., 148, 247–254.
62) Liu, X., Matsushima, A., Shimohigashi, M., & Shimohigashi, Y. (2014) PLoS ONE, 9, e101252.
63) Levchik, S.V. & Weil, E.D. (2005) Polym. Int., 54, 981–998.
64) http://ntp.niehs.nih.gov/testing/noms/index.html
65) Rosenmai, A.K., Dybdahl, M., Pedersen, M., Alice van Vugt-Lussenburg, B.M., Wedebye, E.B., Taxvig, C., & Vinggaard, A.M. (2014) Toxicol. Sci., 139, 35–47.
66) Kinch, C.D., Ibhazehiebo, K., Jeong, J.-H., Habibi, H.R., & Kurrasch, D.M. (2015) Proc. Natl. Acad. Sci. USA, 112, 1475–1480.
67) Usman, A. & Ahmad, M. (2016) Chemosphere, 158, 131–142.
68) Terasaki, M., Shiraishi, F., Nishikawa, T., Edmonds, J.S., Morita, M., & Makino, M. (2005) Environ. Sci. Technol., 39, 3703–3707.
69) Kitamura, S., Suzuki, T., Sanoh, S., Kohta, R., Jinno, N., Sugihara, K., Yoshihara, S.i., Fujimoto, N., Watanabe, H., & Ohta, S. (2005) Toxicol. Sci., 84, 249–259.
70) Bauzá, A., Mooibroek, T.J., & Frontera, A. (2015) ChemPhysChem, 16, 2496–2517.
71) Desiraju, G.R., Ho, P.S., Kloo, L., Legon, A.C., Marquardt, R., Metrangolo, P., Politzer, P., Resnati, G., & Rissanen, K. (2013) Pure Appl. Chem., 85, 1711–1713.
72) Kolář, M.H. & Hobza, P. (2016) Chem. Rev., 116, 5155–5187.
73) Persch, E., Dumele, O., & Diederich, F. (2015) Angew. Chem. Int. Ed., 54, 3290–3327.
74) 都築誠二,内丸忠文(2014)J. Comp. Chem. Jpn., 13, 328–329.
75) Lu, Y., Shi, T., Wang, Y., Yang, H., Yan, X., Luo, X., Jiang, H., & Zhu, W. (2009) J. Med. Chem., 52, 2854–2862.
76) Fujita, T., Nose, T., Matsushima, A., Okada, K., Asai, D., Yamauchi, Y., Shirasu, N., Honda, T., Shigehiro, D., & Shimohigashi, Y. (2000) Tetrahedron Lett., 41, 923–927.
77) Matsushima, A., Fujita, T., Nose, T., & Shimohigashi, Y. (2000) J. Biochem., 128, 225–232.
78) Matsushima, A., Fujita, T., Okada, K., Shirasu, N., Nose, T., & Shimohigashi, Y. (2000) Bull. Chem. Soc. Jpn., 73, 2531–2538.
79) http://www.rcsb.org/pdb/home/home.do
80) http://www.ccdc.cam.ac.uk
81) Delfosse, V., Grimaldi, M., Cavaillès, V., Balaguer, P., & Bourguet, W. (2014) Environ. Health Perspect., 122, 1306–1313.
82) Kitamura, S., Jinno, N., Ohta, S., Kuroki, H., & Fujimoto, N. (2002) Biochem. Biophys. Res. Commun., 293, 554–559.
83) Hewitt, S.C. & Korach, K.S. (2011) Environ. Health Perspect., 119, 63–70.
84) Turusov, V., Rakitsky, V., & Tomatis, L. (2002) Environ. Health Perspect., 110, 125–128.
85) van der Oost, R., Beyer, J., & Vermeulen, N. (2003) Environ. Toxicol., 13, 57–149.
86) Manna, D. & Mugesh, G. (2012) J. Am. Chem. Soc., 134, 4269–4279.
87) Mullur, R., Liu, Y.-Y., & Brent, G.A. (2014) Physiol. Rev., 94, 355–382.
88) Costantino, L. & Barlocco, D. (2006) Curr. Med. Chem., 13, 65–85.
89) Matsushima, A., Liu, X., Okada, H., Shimohigashi, M., & Shimohigashi, Y. (2010) Environ. Health Perspect., 118, 1267–1272.
90) Delfosse, V., Grimaldi, M., Pons, J.-L., Boulahtouf, A., Le Maire, A., Cavaillès, V., Labesse, G., Bourguet, W., & Balaguer, P. (2012) Proc. Natl. Acad. Sci. USA, 109, 14930–14935.
91) Horard, B. & Vanacker, J.M. (2003) J. Mol. Endocrinol., 31, 349–357.
92) 劉 暁輝,松島綾美,下東康幸(2015)BIO Clinica, 30, 90.
93) 下東康幸,劉 暁輝,松島綾美(2013)Endocrine Disrupter NEWS LETTER, 15, 5.
94) Walker, P., Germond, J.E., Brownluedi, M., Givel, F., & Wahli, W. (1984) Nucleic Acids Res., 12, 8611–8626.
95) Klein-Hitpaß, L., Schorpp, M., Wagner, U., & Ryffel, G.U. (1986) Cell, 46, 1053–1061.
96) Kleinhitpass, L., Kaling, M., & Ryffel, G.U. (1988) J. Mol. Biol., 201, 537–544.
97) Martines, E. & Wahli, W. (1989) EMBO J., 8, 3781–3791.
98) Catherino, W.H. & Jordan, V.C. (1995) Cancer Lett., 92, 39–47.
99) Kato, S., Tora, L., Yamauchi, J., Masushige, S., Bellard, M., & Chambon, P. (1992) Cell, 68, 731–742.
100) Lannig, A., Koszewski, N.J., & Notides, A.C. (1993) Mol. Cell. Endocrinol., 94, 47–54.
101) Klinge, C.M., Franklin, V., Peale, J., Hilf, R., Bambara, R.A., & Zain, S. (1992) Cancer Res., 52, 1073–1081.
102) Hall, J.M. & McDonnell, D.P. (1999) Endocrinology, 140, 5566–5578.
103) Hall, J.M. & Korach, K.S. (2002) J. Biol. Chem., 277, 44455–44461.
104) Geserick, C., Meyer, H.-A., & Haendler, B. (2005) Mol. Cell. Endocrinol., 236, 1–7.
105) Ke, Z.-H., Pan, J.-X., Jin, L.-Y., Xu, H.-Y., Yu, T.-T., Ullah, K., Rahman, T.U., Ren, J., Cheng, Y., Dong, X.-Y., Sheng, J.-Z., & Huang, H.-F. (2016) Sci. Rep., 6, 31331.
106) Eudy, J.D., Yao, S.F., Weston, M.D., Ma-Edmonds, M., Talmadge, C.B., Cheng, J.J., Kimberling, W.J., & Sumegi, J. (1998) Genomics, 50, 382–384.