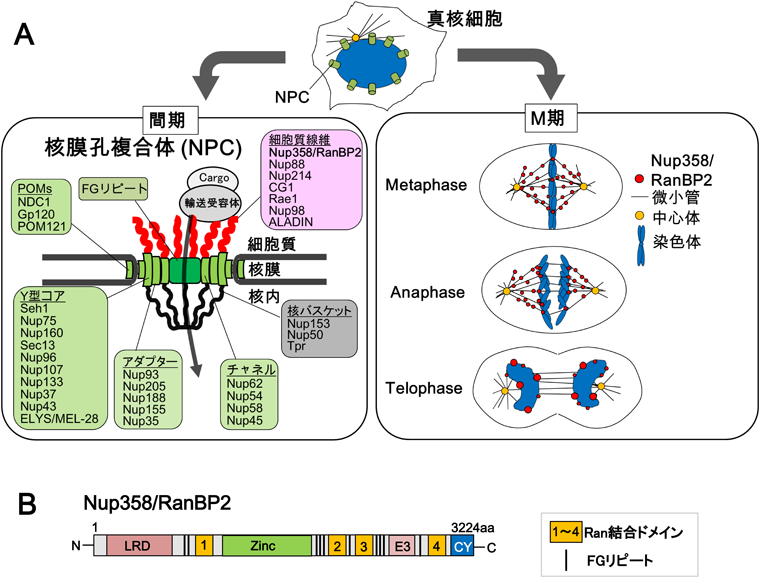
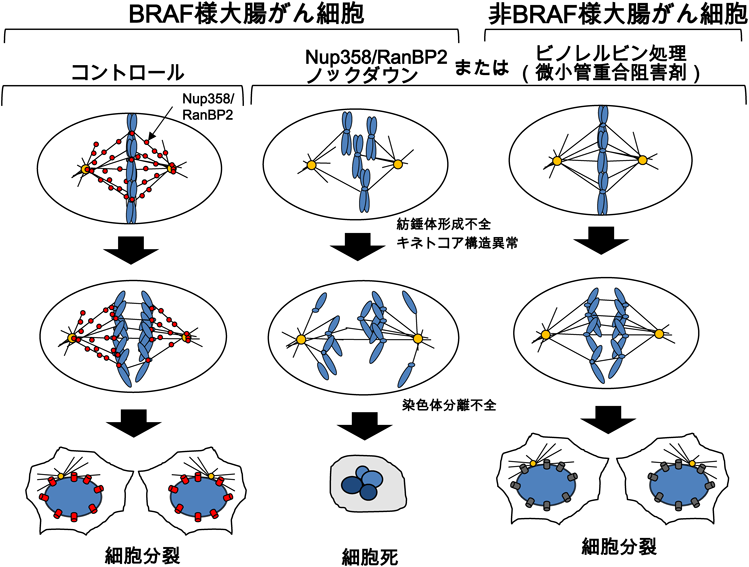
有糸分裂期の機能性ヌクレオポリン:大腸がんの病態解明と治療への応用Mitotic nucleoporin orchestrates colorectal carcinogenesis
1 金沢医科大学医学部血液免疫内科学Division of Hematology/Immunology, Department of Medicine, Kanazawa Medical University ◇ 〒920–0293 石川県河北郡内灘町大学1–1 ◇ 1–1 Daigaku, Uchinada, Ishikawa 920–0293, Japan
2 金沢大学がん進展制御研究所腫瘍制御研究分野Divisions of Translational and Clinical Oncology and Surgical Oncology, Cancer Research Institute and Cancer Center, Kanazawa University and Hospital ◇ 〒920–0934 金沢市宝町13–1 ◇ 13–1 Takara-machi, Kanazawa 920–0934, Japan
3 金沢大学新学術創成研究機構セルバイオノミクスユニットCell-bionomics Research Unit, Innovative Integrated Bio-Research Core, Institute for Frontier Science Initiative;Bio-AFM Frontier Research Center & Lab of Molecular Cellular Biology, School of Natural System;Kanazawa University ◇ 〒920–1192 金沢市角間町 ◇ Kakuma-machi, Kanazawa 920–1192, Japan)