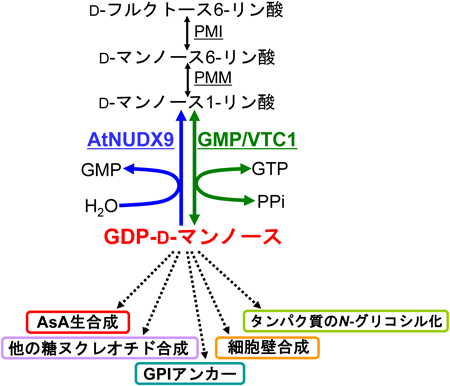
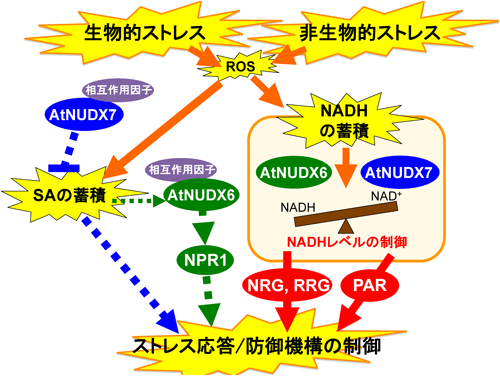
植物Nudix hydrolaseファミリーの機能解析の進展—細胞内GDP-D-マンノースおよびNADH代謝制御の新たな役割—Recent advances in functional analysis of plant Nudix hydrolase family—novel roles of metabolic regulation of GDP-D-mannose and NADH—
1 島根大学生物資源科学部生命工学科Faculty of Life and Environmental Science, Shimane University ◇ 〒690–8504 島根県松江市西川津町1060 ◇ 1060 Nishikawatsu, Matsue, Shimane 690–8504, Japan
2 近畿大学農学部バイオサイエンス学科Department of Advanced Bioscience, Faculty of Agriculture, Kindai University ◇ 〒631–8505 奈良県奈良市中町3327–204 ◇ 3327–204 Nakamachi, Nara 631–8505, Japan
3 中部大学応用生物学部食品栄養科学科Department of Food and Nutritional Science, College of Bioscience and Biotechnology, Chubu University ◇ 〒487–8501 愛知県春日井市松本町1200 ◇ 1200 Matsumoto-cho, Kasugai, Aichi 487–8501, Japan