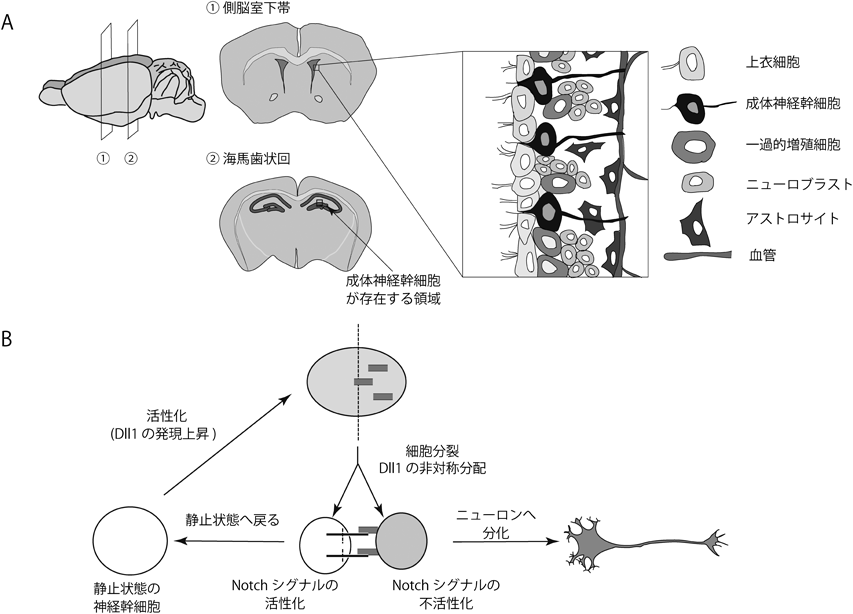
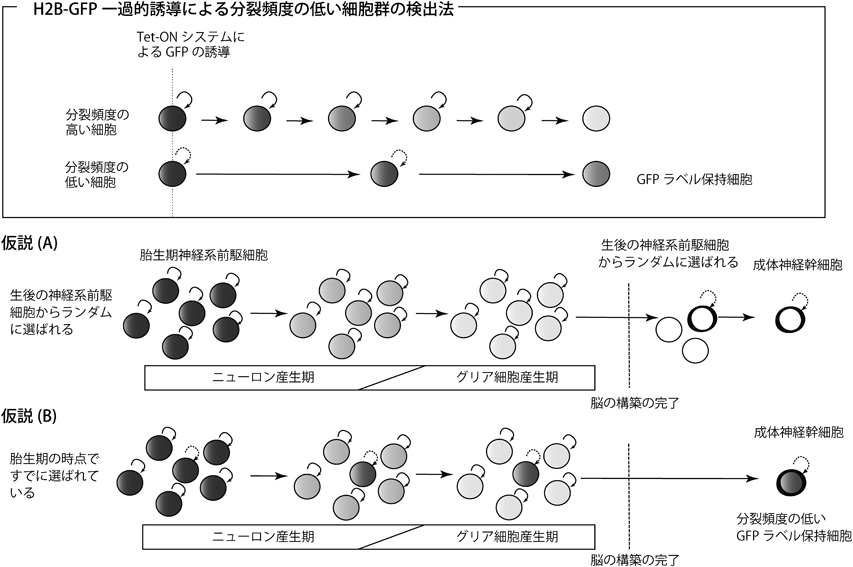
成体神経幹細胞の未分化性維持機構と発生起源についてEmbryonic origin of adult neural stem cells
東京大学大学院薬学系研究科分子生物学教室Laboratory of Molecular Biology, Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 薬学部本館3階 333–338号室 ◇ Main Bldg. 3F No. 333–338, 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan