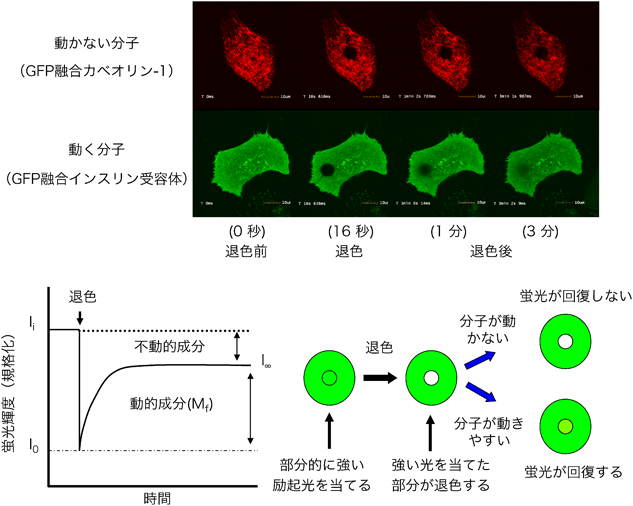
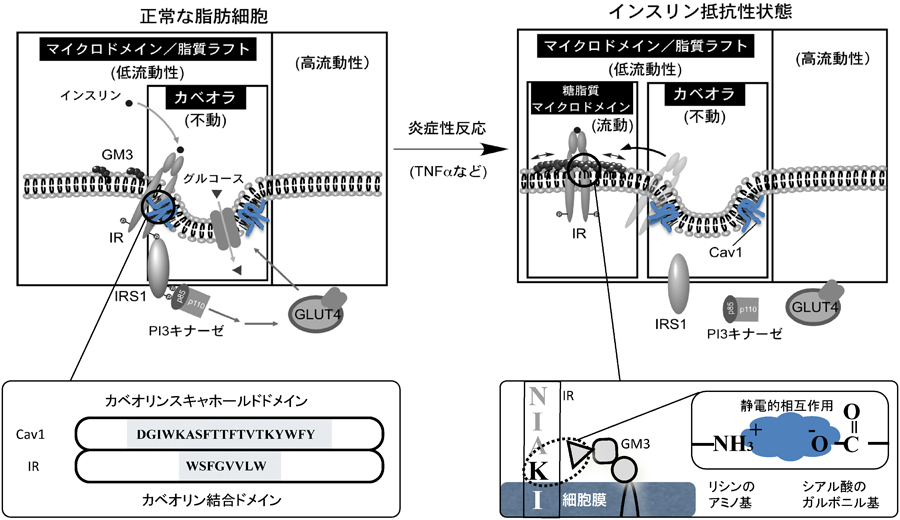
ガングリオシドと膜タンパク質の静電的相互作用Electrostatic interaction between ganglioside and membrane proteins
大阪大学大学院理学研究科化学専攻Department of Chemistry, Graduate School of Science, Osaka University ◇ 〒560–0043 大阪府豊中市待兼山町1–1 ◇ 1–1 Machikaneyama-cho, Toyonaka, Osaka 560–0043, Japan