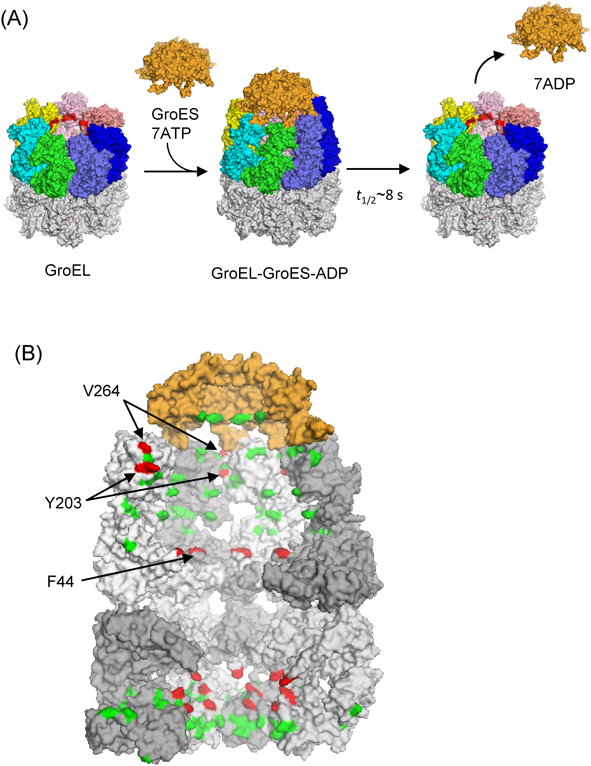
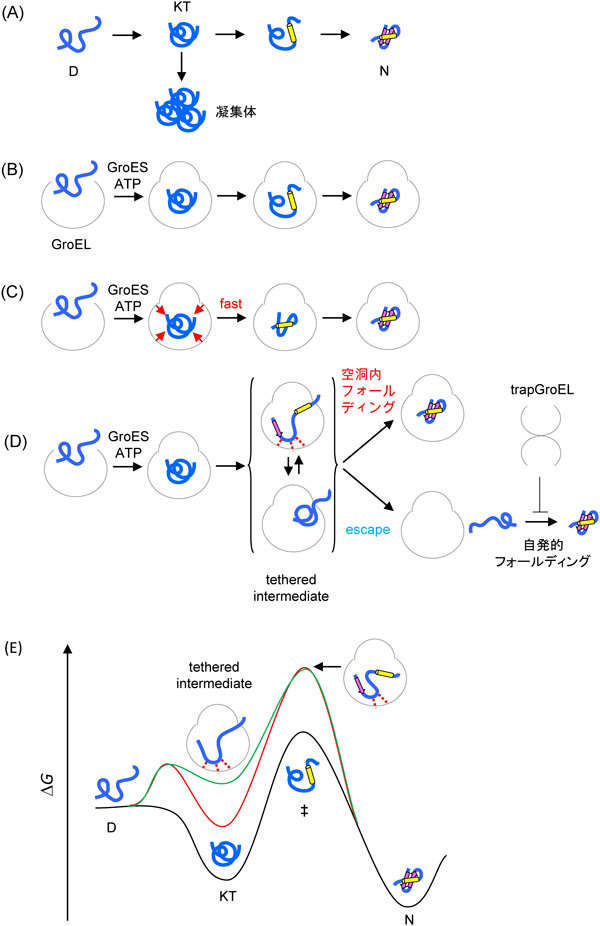
フォールディングを改善するシャペロニンのテザリング効果Tethering effect by which improves protein folding in the chaperonin cage
富山県立大学・工学部・生物工学科および生物工学研究センター,JST-ERATO浅野活性分子プロジェクトBiotechnology Research Center and Department of Biotechnology, Toyama Prefectural University, Asano Active Enzyme Molecule Project, ERATO, JST ◇ 〒939–0398 富山県射水市黒河5180 ◇ 5180 Kurokawa, Imizu, Toyama 939–0898, Japan