1)ケミカルライブラリーとしてのペプチドの多様性
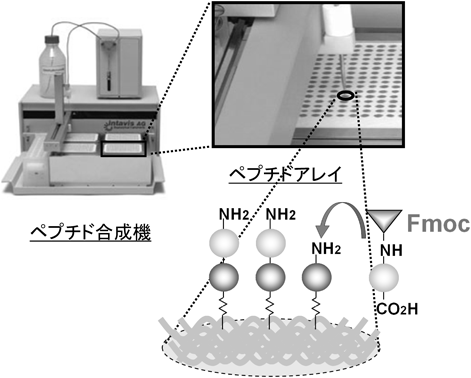
ペプチドはアミノ酸のポリマーである.一般に,タンパク質分子を形成するアミノ酸は天然アミノ酸であるL型に限っても20種類あり,6アミノ酸長(6-mer)のペプチドではその組合わせにより6400万種類にも及ぶ多様性を持つ.したがってペプチドは,医薬品原薬や機能性食品素材のリード化合物探索のためのライブラリーとして十分に広い配列多様性を持つ.ゆえに,アミノ酸の配列はきわめて重要であり,配列を最適化することでさまざまな機能を持つペプチドがデザインできる.我々は,ペプチド固相合成法という手法でペプチドをアレイ状にスポット合成する装置(図1)を使い,数百種類のペプチドを合成し,機能性ペプチドの探索を試みている.
後述するように,我々はタンパク質などの生体分子と結合して機能するペプチドを多数探索した.コレステロールは,腸管内で胆汁酸とミセルを形成し吸収される.我々が探索したコレステロール吸収阻害ペプチド(たとえばPWWWMY)は,胆汁酸の一種,タウロコール酸(log P値=2.2の疎水性分子)に結合できる比較的疎水性の高い分子である1).また,アミラーゼ阻害ペプチド(RHWYYRYW)は多糖構造を模倣してαアミラーゼの多糖結合ポケットに先回りして結合できるペプチドである2).タンパク質分子を形成するL型のアミノ酸に限ってみても,その疎水度(log P値)は−4.2(アルギニン)から−1.05(トリプトファン),等電点は10.76(アルギニン)から2.77(アスパラギン酸)である.さらにペプチド結合でポリマーになれば,疎水性が増し,等電点も変更可能である.
一方,ペプチドは短鎖でも機能性を持つものが知られている.血圧安定化作用を示すペプチド(ラクトトリペプチド)や細胞接着ペプチド(RGD)はその好例である.我々は,この魅力的な,そして非常に膨大なワールドから目的のペプチドを探索するため,①まず数百種類の短鎖ペプチドをペプチドアレイにより合成し,機能性を持つペプチドを評価する,②次にそれらの機能性ペプチドの特徴を,特定位置のアミノ酸の特徴で説明するという探索法を提案している3, 4).本稿では,これらのペプチド探索法を使った“ペプチドライブラリーによる創薬探索”の可能性に関して紹介する.
2)ファージディスプレイとの比較
機能性ペプチドの探索では,多くの研究者がファージディスプレイ法を試みている.この方法はキット化されていて利用しやすい.しかし,一方で,ファージディスプレイ法でのスクリーニングに不安を感じている研究者は少なくない.確かに結合するペプチドは得られたけれど,はたして本当にこれが最良のペプチドなのか(検出漏れの危険性),これ以外に同様の活性を持つペプチド配列はないのか(類似性の危険性)という不安である.
我々は,ファージディスプレイ法で得られた酸化亜鉛(ZnO)微粒子を認識するペプチドEAHVMHKVAPRPをシード配列にして,同じ組成で配列の異なる類縁体ペプチドをペプチドアレイにて合成し,ZnOとの認識能を評価した.その結果,HPVPRHMVAEAKやKAEAHVPMHVPRがシード配列より高い認識能を持つことを発見した5).これは,(i)ファージディスプレイ法による探索が万能ではなく,スクリーニング漏れがあり,また(ii)同程度の機能を持つ短鎖ペプチドが実際に存在することを示している.検出漏れは,発現困難なペプチドであったためかもしれないし,ファージ表面タンパク質と発現ペプチドとの相互作用が無視できないためかもしれない.最近ではディスプレイ法でも次世代シーケンサを用いた網羅的解析を組み合わせて配列機能解析が試みられている6).
3)受容体ライブラリーによる探索
注目するタンパク質に結合して機能を発揮するペプチドを探索するため,タンパク質間相互作用を活用する方法がとられる.すなわち,受容体(レセプター)が知られているタンパク質では,そのリガンド機能を代替するペプチドを探索するため,受容体ペプチドライブラリーを合成する.
我々は,アンジオテンシン結合ペプチドの探索のためにアンジオテンシン受容体ライブラリーを作製した.アンジオテンシンをフルオレセインイソチオシアネート(FITC)で蛍光ラベルしたプローブで結合するペプチドを探索した結果,6残基のVVIVIYを見いだし,このペプチドがラット大動脈組織を使った血管収縮作用を84%抑制できることを明らかにした7).
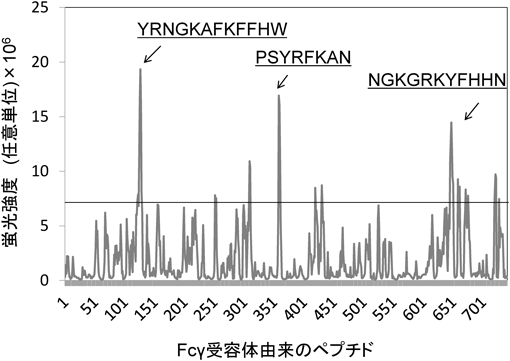
もう一つの例として抗体IgGのFc領域に結合するペプチドの探索をあげる.抗体は生化学検査だけでなく,抗体医薬として注目される重要な生体分子である.我々はそのFc領域に結合するペプチドを探索するためFcγ受容体I, II, IIIの3種類の配列,全740種類の6-merペプチド受容体ライブラリーを作製し,IgG-Fc認識ペプチドを探索した.その結果,図2に示すように,3種類の高結合配列が探索できた8).
4)ペプチドアレイ細胞機能アッセイ法による探索
上記のように,リガンドの結合をin vitroで評価することが可能な場合は,蛍光ラベルしたリガンドが利用できるため探索しやすい.しかし,単離精製が困難な受容体で容易にin vitroアッセイ系が構築できない場合や,ターゲットになる受容体が特定されていない場合は,細胞を使って直接評価する方法が有効である.そこで我々は,アレイ表面のペプチドと細胞表面上の受容体(たとえばインテグリン)を直接相互作用させることで,シグナル伝達に伴って引き起こされる細胞の変化(ペプチドの機能)を直接検出できる“peptide array-cell assay system”を開発した9).これは,合成したペプチドアレイを十分に乾かした後,生検用のパンチを用いて直径6 mmのディスク状にくりぬき,96穴の培養プレートに沈め,細胞を播種した後一定時間後の生細胞数をカルセインAMで染色し検出する方法である.
我々はがん細胞選択的にアポトーシス(周囲の正常な組織に影響を与えない細胞死)を誘導するTRAIL(TNF related apoptosis inducing ligand)に注目し,TRAIL配列ライブラリーを作製し,上記の方法で探索を行ったところ,TRAILと同様な機能を持ったペプチドとしてRNSCWSKD配列を発見した10).
間葉系幹細胞(mesenchymal stem cell:MSC)は骨芽細胞・脂肪細胞・軟骨細胞・筋細胞などに分化することができる分化能と自己複製能を合わせもつ細胞で,再生医療に有効な細胞である.我々はフィブロネクチンのアミノ酸配列をもとに6残基ペプチドライブラリーを作製し,MSC接着ペプチドの探索を行った結果,細胞接着ペプチドとして知られているRGDと同等の活性を持った配列ALNGRを探索することに成功した11).また,動物の組織において上皮細胞層と間質細胞層を分ける基底膜に存在する主要な細胞外マトリックス,コラーゲンタイプIV(ColIV)に注目し,血管内皮細胞(endothelial cell:EC)と平滑筋細胞(smooth muscle cell:SMCs)に選択的に接着するペプチドを探索したところ,トリペプチドCAGが最もEC選択性が高いことがわかり,PCL(poly-ε-caprolactone)にCAGを含浸させることで,EC接着性が非常に高いシートを作製できた12).
5)アミノ酸配列の残基置換による探索
上述の機能性ペプチドはいずれも生体内に存在するタンパク質由来のアミノ酸配列である.ペプチドのバリエーションから考えると生体内に存在しない機能未知のペプチドは無数にあると考えられる.そこで,探索した実在のタンパク質上のアミノ酸配列を置換して,まったく新規の機能性ペプチドの探索を試みた.
3)で述べたIgG-Fc結合ペプチドとして探索した配列に関して,配列置換と短鎖化を試みたところ,FcγRI由来のYRNGKAFKFFHWという12-merの高結合配列からは8-merペプチドNARKFYKGが,またFcγRIII由来のNGKGRKYFからはNKFRGKYKという高結合活性を示すペプチドが得られた.いずれもIgGへの結合定数は106 M−1のオーダーで非常に高く,IgGの精製に使えるだけでなく8),その相補配列と組み合わせることでIgG検出にも使えることを明らかにした13).
4)で述べた細胞死誘導ペプチドRNSCWSKDについても改変ペプチドを合成し評価した.各アミノ酸残基をそれぞれ他の19種類に置換した配列(たとえばANSCWSKDなど),全152配列を作製した(19種類×8か所=152種類).細胞死誘導活性を評価した結果,元の配列RNSCWSKDより5倍程度活性が高いCNSCWSKDを得た14).
我々のペプチドアレイの技術では,合成したすべての配列が,どれくらいの活性を示すのかを定量的に明らかにすることができる.そこで我々は,情報解析の方法を用いて,構成するアミノ酸残基の特徴量とペプチドの機能との相関を調べた.アミノ酸残基の特徴量としては,疎水度,電荷,サイズ,高次構造の安定性などのアミノ酸インデックスを使用した.
1)コレステロール吸収抑制ペプチドのルール
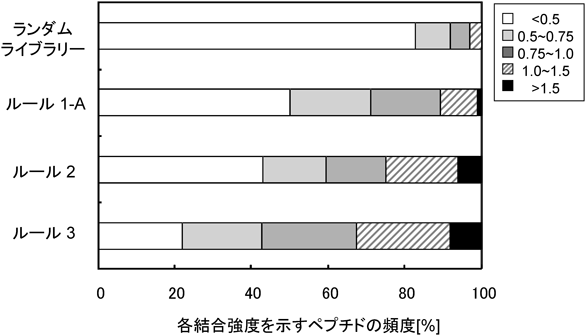
コレステロールは胆汁酸ミセルに取り込まれて小腸壁から吸収される.ダイズ由来のペプチドVAWWMYは,胆汁酸に結合し,ミセル崩壊を促すことでコレステロールの吸収を抑制できる.この原理に基づき,2212種類のペプチドライブラリーを作製し,胆汁酸との結合活性を調べた結果,「N末端3残基目のアミノ酸のサイズが大きく,4残基目のタンパク質安定化指標が大きいと胆汁酸結合活性が高い」,さらに「N末端2残基目のアミノ酸のタンパク質安定化指標が大きいと胆汁酸結合活性が高い」というルールが得られた.ルールに合致したライブラリーを作製して評価したところ,約45%が高活性のペプチドであった(ランダムライブラリーではわずか6%,図3)1).また,既知のダイズグリシニンタンパク質由来VAWWMYペプチドよりも高結合性を示す配列も得られ,VIWWFKやPWWWMYという高活性ペプチドをラットに投与したところ,血清,肝臓,小腸でのコレステロール吸収量が1/2から1/3に低下することがわかった.
2)細胞接着ペプチドのルール
前節4)の“peptide array-cell assay system”を使って線維芽細胞接着ペプチドを探索した.643種類の5-merランダムペプチドライブラリーを作製して評価した結果,「N末端アミノ酸のサイズが小さく,2残基目の電荷が大きく,3残基目のサイズと電荷が大きく,4残基目のサイズが小さければ細胞接着ペプチドとして機能する」,さらに「3残基目のサイズと電荷が大きければ細胞接着ペプチドになる」というルールが得られた.このルールに従ってペプチドを作製したところ,活性の高い配列は84%と約4倍以上含まれることがわかり,線維芽細胞の接着に重要なルールであることが実証できた3).このペプチドは,再狭窄を防ぐ人工血管表面修飾分子として使える可能性がある.このように配列機能相関(ルール)を組み合わせれば,最初からライブラリーが網羅されていなくても高機能性ペプチドが探索できることがわかる.
3)合理的な探索法の構築
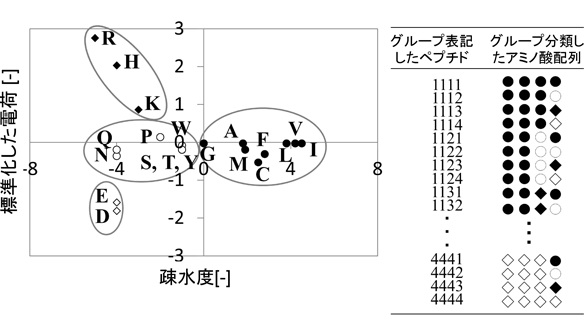
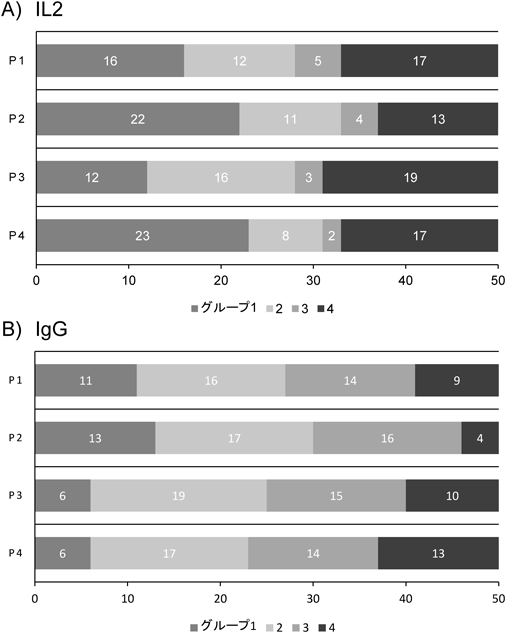
ペプチド探索におけるライブラリーサイズの最小化は重要であり,探索可能で合理的なサイズを決める必要がある.そこで20種類のアミノ酸を疎水度と電荷で4グループに分けて合成する方法を考案した(図4).この方法では4残基ならば原理的に256種類のペプチドライブラリーでよい.2セット512ペプチドで,インターロイキン2(IL2)とIgG抗体に対して結合する4残基ペプチドの探索を試みた.高結合を示すペプチドの特徴を調べたところ,図5に示すように,両者の間で使われるグループに偏りがあった.IL2ではグループ1(疎水性アミノ酸)およびグループ4(負電荷アミノ酸)で構成されるペプチドが多く,IgG高結合ペプチドはグループ2(親水性アミノ酸)が多くグループ1とグループ4が少ない.これはIL2の等電点が7.7であり,実験条件(pH 7.4)ではタンパク質表面が正電荷を持っているためと考えられる15).このことから,512ペプチドで特徴的な配列ルールを抽出できることがわかった.
この方法では,4残基のペプチドに対して256種類のペプチドライブラリーで高活性ペプチドが得られた.しかし,残基数が一つ増すごとにライブラリーサイズは4倍ずつ大きくなる.長さの長い高機能性ペプチドを探索するためには短鎖のペプチドで得られたルールの拡張を目指すほうがよい.このため,IL2とIgGに対して得られた4残基ペプチドの特性を8残基に拡張する方法について検討した.4残基での解析結果を主成分分析して配列機能相関を試み,8残基ペプチドの機能解析に応用した.その結果,アミノ酸残基の電荷,疎水度,サイズなど物理的因子の平均値,最大値,最小値といった16ないし18種類のパラメータを使って4残基ペプチドの主成分分析を行ったところ,高活性と特定できる領域があることがわかった.使用したパラメータは“アミノ酸配列の位置情報を含んでいない”ため,同じ主成分を使うと8残基に拡張可能である.その結果,8残基でも,同じ領域に高活性ペプチドが集まっていることを明らかにした16).この方法は長鎖機能性ペプチドの探索法として期待できる.
上述のペプチドは,固相合成法でありC末端が拘束されているライブラリーで探索できた機能性ペプチドである.実際には遊離状態で機能を発現するペプチドや,複数分子で機能を発現するペプチドの探索も重要である.このため,これらの新規機能性ペプチドを探索するための技術開発も進めている.
1)遊離ペプチドライブラリー
C末端拘束ペプチドは,遊離ペプチドに比べるとタンパク質との結合に不利に働く.多くのペプチドは遊離状態で使用されるので,最初から遊離状態で探索できたほうがよい.このため紫外線照射で解裂・遊離できるフォトリンカー(4-[4-(1-(Fmoc amino)ethyl)-2-methoxy-5-nitrophenoxy]butanoic acid)を合成し2),紫外線照射でペプチドが遊離できるライブラリーを作製し,糖尿病の症状を改善するため実用化されているアミラーゼ阻害剤の探索を試みた.ペプチドアレイを合成した後,光解裂させ,96穴プレートにパンチアウトし,緩衝液を加えて遊離ペプチドとした.このライブラリーに膵液アミラーゼを添加し,合成基質を用いた酵素活性測定で,ペプチドの阻害活性を評価した.その結果,RHWYYRYWという8-merペプチドが探索できた2).このペプチドの阻害様式は拮抗阻害であり,その阻害定数は4.65 µMであり,既存の糖尿病治療薬アカルボースの阻害定数8.9 µMより高い阻害活性を示した.消化管での加水分解の問題が解決できれば糖尿病治療薬として実用化できる可能性が高い.
2)分岐鎖ペプチドライブラリー
タンパク質分子が2種類組み合わさることでシグナルが伝わることがある.アレルギー反応(アレルゲンによる受容体の二量体化)もその一つである.そこで,2種類のペプチドを組み合わせて合成する分岐鎖ペプチドライブラリーの合成を試みた.これは主鎖をFmoc基,側鎖をivDde基で保護したリシンを用い,主鎖と側鎖に別々のアミノ酸を合成することで実現できる.この方法により,2種類のIgEエピトープを合成し,RBL-2H3細胞によるヒスタミン放出が検出できた17).この方法はヘテロ2分子でもホモ2分子でも可能であり,ペプチドの組合わせ効果を検証するためにユニークなツールになるものと期待できる.
3)ペプチド間相互作用に基づく分析プローブの開発
生体分子の非標識分析は合成が容易で分析ステップも単純化できる.ナノ微粒子は凝集状態で色調が変化する.このため,ナノ微粒子を凝集させる機能(可視化機能)と分子認識機能を持つペプチドの探索を行った.
銀ナノ微粒子(AgNP)は正電荷を持つペプチドで凝集する.アンジオテンシン(Ang)受容体由来のライブラリーを使い,Ang結合能を持ち正電荷アミノ酸を多く含むペプチドを探索した.その結果,上述のVVIVIYよりAng結合能は劣るがK, Rを多く含むペプチドKGKNKRRRを発見した.Angを含まないAgNP分散溶液中にこのペプチドを添加すると溶液がピンク色に変化するが,Ang存在下では凝集が阻害され黄色のままである.この方法により,10 µMまでのAngを15分で検出できることがわかった18).この方法は上述の抗体認識ペプチドNKFRGKYKにも応用できた.このペプチドも2機能性ペプチドであり,実際の抗体生産ハイブリドーマの培養液を使ったところ,100~500 nMまでの抗体を含む溶液を2分間で検出できた19).
蛍光色素は近傍にクエンチャー分子があると光誘起電子移動(PeT)機構により消光する.Atto655とトリプトファンの組合わせはよく知られている.まず上述の抗体Fc領域認識ペプチドに対して相補するペプチドを探索した.クエンチャーつき相補ペプチドと蛍光分子つきFc認識ペプチドを合成したところ,抗体の有無を検出できる2分子分析系が構築できた20).次に両者をタンデムに連結し1分子で生体分子の検出が可能なペプチド誘導体(peptide beaconと呼ばれる)の開発を試みた(図6A).C末端にトリプトファン4残基,N末端にAtto655を結合させた分子を設計したところ,抗体非存在下で消光しており,存在下で分子が開き,蛍光を発することを明らかにした.抗体検出感度は250 nMであり簡易計測に使用可能であった(図6B)21).
4)細胞内機能性ペプチドの探索
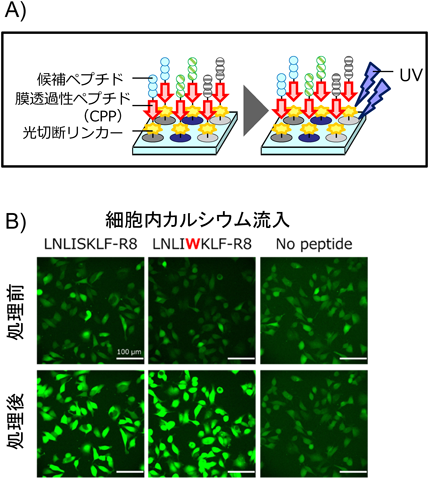
これまでに見つかった機能性ペプチドはいずれもタンパク質との結合や細胞外から細胞に作用するペプチドであった.細胞内で機能するペプチドの探索は,新たな創薬ターゲットとして重要である.すでに多くの研究者により細胞膜透過性ペプチド(cell-penetrating peptide:CPP)の研究が進められている.我々は,上記のフォトリンカーとCPPであるアルギニンホモポリマーR8ペプチドを組み合わせ,さらにライブラリーペプチドを連結して,細胞内で機能するペプチドが探索できるライブラリーの構築を目指した.ライブラリーペプチドとして31種類のトリペプチドを取り上げ,FITCつきR8連結ペプチドとして合成し,紫外線照射で遊離した上で96穴プレートにパンチアウトし,HeLa細胞を播種して細胞内導入実験を試みたところ,18種類はCPPのみでの細胞内導入量より高い導入量を示し,5種類は同等,残り8種類は導入量が有意に減少した.トリペプチドを疎水度(hydrophobicity:H)と等電点(isoelectric point:pI)で整理した結果を図7に示す.トリペプチド全8000種類を図中に小さいドットで示し,試験した31種類のペプチドはダイヤ印で示す.負電荷を持つ親水性のペプチドで導入効率が低下することがわかった22).この現象は5-merのペプチドでも再現しており,汎用性が確認できた.R8は正電荷ペプチドである.このため負電荷を持つペプチドを連結するとR8でも細胞内導入しにくくなった.このグラフを使えば,細胞内導入可能ペプチドライブラリーが構築でき,細胞内機能性ペプチドの探索が可能になる.細胞内機能性ペプチドの探索に関しては,ミトコンドリアを標的とする細胞死誘導ペプチドLNLISKLFを対象として残基置換を試み,さらに強い細胞死誘導活性を示すペプチドの探索に成功した(図8).今後もこの系を使って細胞内機能性ペプチドの探索を進めていく.現在では,細胞内に導入した後で解裂することができるリンカーも開発しており,さらに探索のターゲットを拡げることが可能である.
引用文献References
1) Takeshita, T., Okochi, M., Kato, R., Kaga, C., Tomita, Y., Nagaoka, S., & Honda, H. (2011) J. Biosci. Bioeng., 112, 92–97.
2) Ochiai, T., Sugita, T., Kato, R., Okochi, M., & Honda, H. (2012) Biosci. Biotechnol. Biochem., 76, 819–824.
3) Kaga, C., Okochi, M., Tomita, Y., Kato, R., & Honda, H. (2008) Biotechniques, 44, 393–402.
4) 本多裕之(2009)生物工学会誌,87, 280–282.
5) Okochi, M., Sugita, T., Furusawa, S., Umetsu, M., Adschiri, T., & Honda, H. (2010) Biotechnol. Bioeng., 106, 845–851.
6) 小川 隆,宮崎誠生,清瀬紀彦,赤澤陽子,高島瑞紀,萩原義久,井上直和,松田知成,伊東祐二,冨田 勝(2015)KEIO SFC JOURNAL, 15, 364–380.
7) Kato, R., Kunimatsu, M., Fujimoto, S., Kobayashi, T., & Honda, H. (2004) Biochem. Biophys. Res. Commun., 315, 22–29.
8) Sugita, T., Katayama, M., Okochi, M., Ichihara, T., Kato, R., & Honda, H. (2013) Biochem. Eng. J., 79, 33–40.
9) Kato, R., Kaga, C., Kunimatsu, M., Kobayashi, T., & Honda, H. (2006) J. Biosci. Bioeng., 101, 485–495.
10) Okochi, M., Nakanishi, M., Kato, R., Kobayashi, T., & Honda, H. (2006) FEBS Lett., 580, 885–889.
11) Okochi, M., Nomura, S., Kaga, C., & Honda, H. (2008) Biochem. Biophys. Res. Commun., 371, 85–89.
12) Kanie, K., Narita, Y., Owaki, J., Zhao, Y., Kuwabara, F., Satake, M., Honda, S., Kaneko, H., Yoshioka, T., Okochi, M., Honda, H., & Kato, R. (2012) Biotechnol. Bioeng., 109, 1808–1816.
13) Sugita, T., Okochi, M., & Honda, H. (2014) Chem. Lett., 43, 550–552.
14) Kaga, C., Okochi, M., Nakanishi, M., Hayashi, H., Kato, R., & Honda, H. (2007) Biochem. Biophys. Res. Commun., 362, 1063–1068.
15) Kume, A., Okochi, M., Shimizu, K., Yoshida, Y., & Honda, H. (2016) Biotechnol. Bioprocess Eng.; BBE, 21, 119–127.
16) Kume, A., Kawai, S., Kato, R., Iwata, S., Shimizu, K., & Honda, H. (2017) J. Biosci. Bioeng., in press.
17) Sugiura, H., Okazaki, N., Sugiura, T., Honda, H., & Okochi, M. (2014) Biochem. Eng. J., 87, 8–14.
18) Okochi, M., Kuboyama, M., Tanaka, M., & Honda, H. (2015) Talanta, 142, 235–239.
19) Okochi, M., Kamiya, T., Omasa, T., Tanaka, M., & Honda, H. (2016) Anal. Sci., 32, 93–97.
20) Sugita, T., Okochi, M., & Honda, H. (2014) Chem. Lett., 43, 550–552.
21) Okochi, M., Sugita, T., Tanaka, M., & Honda, H. (2015) RSC Advances, 5, 91988–91992.
22) Matsumoto, R., Okochi, M., Shimizu, K., Kanie, K., Kato, R., & Honda, H. (2015) Sci. Rep., 5, 12884.