3. 細胞透過性ペプチドによるBBB透過性の治療用分子送達
1)中枢神経へ到達するCPPとその概要
近年では脳の疾患に対し,多方面からの治療アプローチができるようになったが,副作用の危険性を抑えながら高用量の薬剤を投与することはいまだ実現されていない.
したがってBBBを通過する効率的な治療用分子送達システムの開発は依然として急務である.近年の分子生物学の急速な進歩により,BBBの分子レベルでの機能も明らかになりつつあり,それが新たなデリバリーシステムの開発を可能としている.CNSへの治療用分子の送達に臨床的に適用されたもののさまざまな制限を受けてきたこれまでの送達システムの大部分と比較して,CPPは送達システムのベースとして組み合わせることで,低毒性ながらも高効率に巨大分子を細胞膜透過させるという優位性を持つ19).最大でも30アミノ酸程度であるCPPのサイズを考慮すると,両親媒性(親水性と疎水性の性質を併せ持つ)とカチオン性という特徴のどちらか一方,あるいは両方を有するCPPは他の送達システムよりもBBBを透過する可能性が高く,CNS関連疾患の治療に対する非常に有望なツールだと考えられている20).
ヒト免疫不全ウイルス1型(HIV-1)に由来するtrans-activator of transcription(TAT)は最初に発見されたCPPであり,周囲の培地から効率的に培養細胞内に取り込まれることが確認された19, 20).Antpとして知られているAnother penetratinはキイロショウジョウバエのアンテナペディア転写因子由来のペプチドであり21),TATと同様に初期に発見された天然のタンパク質由来のCPPとして一つのグループを形成している.これら以降,効果的な導入特性を持つCPPが数多く発見されてきた.CPPの第二のグループとして,キメラ分子で構成されたペプチドがあげられる.Transportan(TP)は神経ペプチドであるガラニン由来の12アミノ酸と,ハチ毒であるマストラパン由来の14アミノ酸を融合して作られたペプチドである22).CPPの第三のグループは合成ペプチドファミリーであり,中でもポリアルギニンについての研究は盛んに行われている23).
CPPはそれぞれサイズやアミノ酸配列は異なるが,細胞膜を横切ってさまざまな分子を輸送できることを共通の特徴としている.さらにいくつかのCPPはBBBを透過することも可能であり,種々の治療用分子の送達を容易にする分子送達ベクターとして利用することができる.CNS疾患の治療を目的とした治療用分子送達の改善のためにさまざまなCPPを用いた研究が進められており,現在使用されているCPPとしてTAT, Angiopep,ペネトラチン,TP,狂犬病ウイルス糖タンパク質(rabies virus glycoprotein:RVG),プリオンペプチド,およびSynBなどがあげられる24–28).
CPPはそれぞれ輸送する分子や細胞の種類により異なる侵入経路をとるが,その詳細なメカニズムについてはいまだ議論の余地を残している.現在では細胞膜を直接透過する機構と,エンドサイトーシスを介した機構の2通りが主に提唱されている.
CPPの直接的な細胞膜の透過は,培養細胞の培地を4°Cまで下げても進行するエネルギーに依存しない細胞プロセスであり,それは負に帯電したリン脂質との静電的相互作用が関与すると考えられている29).最近では細胞膜を直接透過するためには,脂質二重層の両側のリン酸基と,CPPとの間における相互作用が関与すると考えられており,膜の疎水性コアを横切る荷電残基の転位や,水性トロイダル型ポアの形成を介して荷電したペプチドが受動拡散で膜を横断するモデルが提案されている30).
エンドサイトーシスは,細胞外の物質を細胞内に取り込む過程の一つであり,細胞膜が細胞内側に折り込まれることにより始まる.陥凹した細胞膜は根元部分で切断され被覆小胞を形成するが,その後被覆小胞を分解することによって細胞は細胞外の物質を吸収することができる.過去の研究では,ペネトラチンの細胞内移行はエネルギー依存性プロセスであるエンドサイトーシスによるものであり,このプロセスはヘパラン硫酸とポリアルギニンの相互作用によって開始され,エンドサイトーシスを促進することを示している31).
また他の研究では,TATはエンドサイトーシスの一種であるマクロピノサイトーシスにより細胞内部への移行をすることが示されている32).その他のエンドサイトーシスによる細胞内移行は反転したミセル(逆ミセル)の形成に基づいている.逆ミセルは,極性基が内部に集中しており,親油基が溶媒中に外側に延びているコロイド状界面活性物質の凝集体である.このモデルによれば,ペネトラチン二量体は,負に帯電したリン脂質と結合し,そこから脂質二重層の内部に逆ミセルを生成する.逆ミセルを構成することにより,ペプチドは自らを親水性の環境に置き続けることができるのである33, 34).
ここまでを要約すると,CPPはタンパク質,ペプチド,核酸,小分子およびナノ粒子といった治療用分子を細胞に狙いどおりに送達することができ,in vivoおよびin vitroで研究や臨床用途の送達ベクターとして利用できる大きな可能性を持っているといえる.以下より,CPPよりCNSへ送達される物質を大きく「タンパク質,ペプチド」,「核酸」,「小分子薬剤」および「ナノ粒子」の4群に分け,現在まで行われている試みを紹介していく.
2)CPPによるタンパク質およびペプチドの中枢神経への送達
これまで,いくつもの方法で治療用タンパク質やペプチドがBBBを透過する試みが行われており,生理的環境下におけるさまざまな制約を回避する方法が模索されてきた.
遺伝子治療は多くの病気に対する魅力的な治療戦略であるが,核酸を保持したベクターを治療目的で投与してもタンパク質レベルで効果を発揮するためには時間がかかるため,急性脳卒中などの急性疾患に対する使用は現実的ではない.対してCPPを用いて大きなタンパク質を送達する方法は,すばやく簡単かつ安全な送達システムである.CPPの細胞内移入は濃度依存的に起こり,細胞膜の脂質二重層を通過して細胞に入る.最近の研究では,CPPが生物学的に活性を持つペプチドやタンパク質をCNSへ送達できることも示されている35)(表1).
表1 ペプチド・タンパク質を送達するCPP| CPP,アミノ酸配列 | 送達する物質 | 標 的 | 備 考 |
|---|
| TAT, YGRKKRRQRRR | β-Gal/GDNF | 虚血性脳障害 | TAT融合β-Galはマウス脳内で強い酵素活性を示す36)TAT-GDNFは局所的脳虚血後の細胞死から脳の神経細胞を保護する40) |
| TAT, YGRKKRRQRRR | JNK1 | ニューロン | TAT-JNK1は低酸素,低グルコース刺激による神経細胞死を減少させる38) |
| TAT-HA, YGRKKRRQRRR-YPYDVPDVA | Bcl-xL | 脳梗塞 | 局所的脳虚血後,TAT-HA-Bcl-XLの投与により用量依存的にマウスの脳梗塞を減少させる37) |
| RDP, KSVRTWNEIIPSKGCLRVGGRCHPHVNGGGRRRRRRRRR | BDNF/β-Gal/Luc | 脳梗塞 | マウスでの脳梗塞実験でRDP-BDNFは神経保護作用を示す.脳スライスのX-Gal染色によりRDP-β-GalはBBBを通過することが証明された41) |
| dNP2, KIKKVKKKGRK | CTLA4 | 多発性硬化症 | dNP2-CTLA4の投与により多発性硬化症モデルマウスの脱髄が減少する42) |
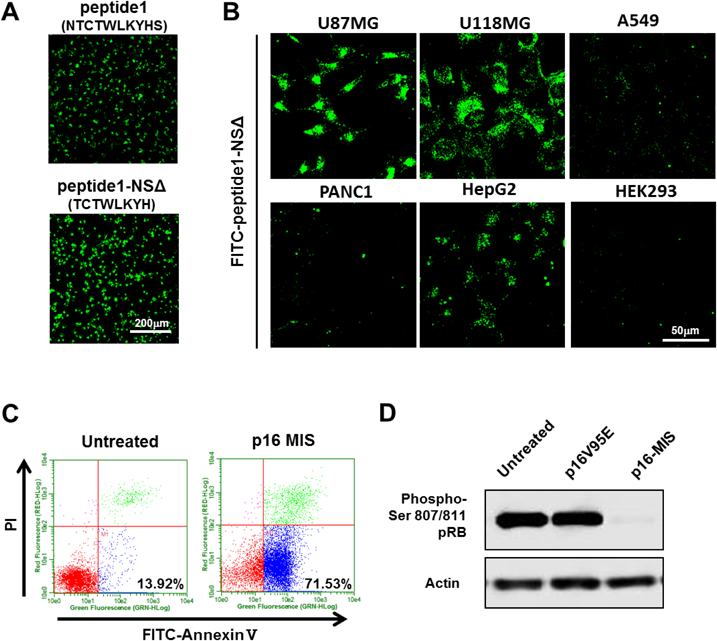
| Peptide-1-NSΔ, TCTWLKYH | p16MIS | 神経膠芽腫細胞株 | Peptide-1-NSΔ-p16MISは神経膠芽腫細胞の増殖抑制,アポトーシスを誘導する76) |
CPPがin vivoにおいても送達を行うという最初の報告はSchwarzeらによって提供された36).彼らはTATと融合したβガラクトシダーゼ(β-Gal)をマウスの腹腔内に注射した場合,脳を含むほぼすべての組織内へそれらが輸送されることを確認している.また,脳卒中のモデルマウスにTAT-Bcl-XL融合タンパク質を注入することにより,虚血性損傷を受けた領域で神経細胞死の死亡率が大きく減少することが報告されている37).同報告では虚血前後のTAT-Bcl-xLの処理により,90分という長時間の虚血性侵襲後であっても梗塞体積および神経障害を減少させられるとしている.さらに,TAT-neuroglobin, TAT-islet-brain-1(IB-1)/JNK-interacting protein-1(JIP-1),TAT-PSD-95, TAT-NR2B9c peptideおよびTAT-GDNFといったCPPを使用することにより,虚血や脳損傷によるダメージから脳を保護できるという報告も数々あげられている34, 38–40).
TAT以外のCPPを用いた例として,RVG由来の39アミノ酸ペプチド(peptides derived from the rabies virus glycoprotein:RDP)と脳由来神経栄養因子(brain-derived neurotrophic factor:BDNF)を融合したRDP-BDNFペプチドはマウスに投与するとわずか15分で脳の神経に到達し,かつ脳梗塞モデルマウスにおいて梗塞体積を減少させるなどの神経保護作用を示している41).
また多発性硬化症は免疫系に異常を来したリンパ球がミエリンを傷害する(脱髄)ことで起こると考えられているが,脊椎動物の遺伝子上にある配列由来のdNP2ペプチドと,リンパ球の活性化を阻害するタンパク質であるCTLA4の断片を融合したdNP2-CTLA4の投与により,多発性硬化症モデルマウスの脱髄を減少させるという報告もある42).
3)CPPによる核酸の送達
プラスミド,siRNA(small interfering RNA),およびアンチセンスオリゴヌクレオチドなどの核酸を培養細胞へトランスフェクションする方法は過去に多数報告されている.ここで,初代培養されたニューロンやin vivoにおける脳の神経細胞へ核酸を移入するために用いられる方法は,ウイルスベクターを用いる方法とそれ以外の方法に大別されている.
ウイルストランスフェクションを生体に対して行う場合,免疫または炎症応答の発生の予測が難しいなど,安全上の懸念が残る.一方,ウイルスを用いない核酸のトランスフェクション法は効率があまり高くないという欠点を持つ.そこでこれらの問題を克服するために,CPP-核酸コンジュゲート法が開発され,非常に強力なツールであることが証明されてきた(表2).
表2 核酸を送達するCPP| CPP,アミノ酸配列 | 送達する物質 | 標 的 | 備 考 |
|---|
| RVG-9RYTIWMPENPRPGTPCDIFTNSRGKRASNG-9R | FvE siRNA | ウイルス性脳炎 | RVG-9Rはマウスの脳内へFvE siRNAを送達し,ウイルス性脳炎から神経細胞を保護する27) |
| TAT, YGRKKRRQRRR | プラスミドDNA | 種々の細胞株(16HBE他) | PEIと比較し,TATはプラスミドを効率的に細胞内へ導入する44) |
| HC-[poly(K)], QYIKANSKFIGITEL-poly(K) | プラスミドDNA | 神経膠腫・神経膠芽腫細胞株 | HC-[poly(K)]-DNAは神経細胞特異的にプラスミドDNAを導入する45) |
| TAT-10H, 5H-YGRKKRRQRRR-5H | プラスミドDNA | 脳実質 | TATと比較し,5H-TAT-5Hと融合したプラスミドDNAはBBBの透過性が向上する46) |
| RVG-9R, YTIWMPENPRPGTPCDIFT-NSRGKRASNG-9R | GAPDH/BACE1 siRNA | 脳実質 | RVG-9RはGAPDH/BACE1 siRNAをニューロン,ミクログリア,オリゴデンドロサイトに送達する52) |
| ペネトラチン,RQIKIWFQNRRMKWKK | Caspase-3/8/9 siRNA, SOD1-1/2 siRNA | 初代培養交感神経,海馬細胞 | ペネトラチン-Caspase-3i/8i/9iは海馬,交感神経特異的にsiRNAを導入する54) |
| ペネトラチン,RQIKIWFQNRRMKWKK | APPアンチセンスオリゴヌクレオチド | 脳室下帯,可溶性APP | ペネトラチン-APPアンチセンスオリゴヌクレオチドは脳室下帯における可溶性APPの発現と神経幹細胞の増殖を抑制する57) |
| TP/TP10, GWTLNSAGYLLGKINLKALAALAKKIL/AGYLLGKINLKALAALAKKIL | NFκBデコイDNA | ラットインスリノーマ細胞株 | TP/TP10とNFκBデコイDNAを融合させるとNFκBの活性化,インターロイキン6の発現が抑制される59) |
遺伝子工学の進歩において重要な役割を担ってきたプラスミドは,特定の部位に任意の遺伝子を挿入することができ,さらにその複合体を生細胞にトランスフェクションできることから有望な治療アプローチとしても期待されている.TATを重合させたMacro-branched TATを使用し,マウス,ハムスター,ヒトなど種々の哺乳動物細胞株にプラスミドDNAをトランスフェクションすると,通常のTATを用いた場合と比較し導入効率が上昇するという報告がある43).また,TATを二~四量体化することでポリ-L-アルギニン等と比較して6~8倍,市販されているリポフェクション試薬やポリエチレンイミン(polyethyleneimine:PEI)と比較して140~390倍もプラスミドDNAのトランスフェクション効率が上昇することが認められている44).
破傷風毒素の非毒性フラグメントとポリリシン[poly(K)]を結合させた場合,DNAとの結合能を向上させ,N18-RE-105細胞(マウス神経芽腫とラット網膜神経細胞のハイブリドーマ)とF98細胞(神経膠腫細胞株)において高いトランスフェクション効率をもたらすことが報告されている45).TATに10個のヒスチジン残基を連結したペプチド(TAT-10H)は,通常のTATと比較し,ヒトおよびラットのグリオーマ細胞株に対するプラスミドDNAのトランスフェクション効率を7000倍に増強させることが観察されている46).さらに同報告において,TAT-10Hペプチドに二つのシステイン残基を組み込むことで効率のさらなる向上が認められている.
中枢神経細胞へ遺伝子をトランスフェクションするために,TATを改変したリポソームやミセルといったCPP改変ナノキャリアを用いる方法も研究が進められている.ポリエチレングリコール(polyethylene glycol:PEG)やPEIによるシールディングは粒子の薬物動態学的挙動を改善したり,リガンドの細胞認識を容易にさせたりするためによく用いられる方法であり,いくつかのグループはCPP修飾ナノキャリアがプラスミド送達のための有効なシステムであることを証明している.たとえばPEI/DNA-TATは遺伝子ベクターの細胞への取り込みを改善し,初代培養した神経細胞への遺伝子トランスフェクション効率を向上させるという報告がある47).
プラスミドDNAの送達とはまた別に,CPPを用いたsiRNAを細胞へトランスフェクションする方法も広く研究されてきた48–50).
RNA干渉(RNA interference:RNAi)は,細胞が相補的なmRNA分子を分解することにより遺伝子をサイレンシングするという天然に存在するプロセスであり,脳腫瘍,神経外傷,疼痛,および感染症といった多くのCNS疾患に対する有望な治療アプローチとなる可能性を秘めている51).しかしながらBBBは,任意のRNA分子に対してほぼ不透過性であり,siRNAもその例外ではない.その理由の一つとして,BBBを通過できる分子は一般的に分子量が400未満だといわれている3)が,多くのsiRNA分子の平均質量が約14,000だということがあげられる.
脳へのsiRNA分子を送達するほとんどの非臨床研究や動物モデルは侵襲性の経路を通るため,全身経路を介しても安全かつ効率的にBBBを通過できる新たな治療用siRNAの開発が求められている.
RVGは神経細胞上のニコチン性アセチルコリン受容体と特異的に相互作用し,ニューロンに侵入することが可能である.これを利用し,Kumarらはマウスにおける致命的なウイルス性脳炎に対し,神経細胞を標的とするRVG-9Rを用いて治療用のsiRNAを送達し,in vivoにおいても神経保護ができることを示した27).Alvarez-Ervitiらは,RVGで修飾したエクソソーム内にsiRNAを組み込み,それをマウスに静脈内注射することにより,脳においてsiRNAが機能することを確認している52).この研究ではマウスに対するRNAi実験により,アルツハイマー病における治療標的分子であるβアミロイド前駆体タンパク質(β-amyloid precursor protein:APP)切断酵素1(APP cleaving enzyme 1:BACE1)をmRNAおよびタンパク質レベルでそれぞれ60%ほどノックダウンしたことを証明している.また,RVGで修飾されたPEIナノキャリア(RVG-PEI-SS)を使用してマウスの脳にsiRNAおよびmicroRNAを送達した報告もある53).
治療用のsiRNA送達系としてその他のCPPが使用されている例もある.チオール系結合を介してペネトラチンとsiRNAを結合したとき,in vitroでは初代培養された哺乳類の海馬と交感神経のニューロンへ,in vivoではラットモデルにおけるCNSへsiRNA二本鎖を送達できることが証明されている54).このアプローチはリポソームを用いたsiRNAの送達と比較して標的細胞への毒性を低く抑えることができる.
数多くのヒトの遺伝性疾患は遺伝子の突然変異によって引き起こされるが,この突然変異が異常な選択的スプライシングを引き起こす場合もある.この種の疾患に対する有望な治療法と一つとして考えられているのが,pre-mRNAスプライシングの補正である.
アンチセンスモルフォリノオリゴヌクレオチド(antisense morpholino oligonucleotide:AMO)は,RNAやDNAの糖部分(リボース,デオキシリボース)の代わりにモルフォリン環を持つ一本鎖DNA誘導体であり,目標点に相補的に結合しスプライシングを部分的に調節することによりpre-mRNAのスプライシングを修正するため,遺伝性疾患への治療応用の可能性を持ったツールの一つである55, 56).しかし,AMOは効率的にBBBを通過することができず,なおかつin vivoにおいて補正効率があまり高くないという欠点を持っている.
それらの問題を解決するため,CPPとAMOを共有結合させることにより膜移行性を向上させ,目的の分子を細胞質,最終的には核にまで直接届ける量を増やす試みがされてきた.たとえば,アルギニンリッチCPPの一種である(RXRRBR)2XB(R=l-アルギニン,X=6-アミノヘキサン酸,B=β-アラニン)と特定のAMOをコンジュゲートした場合,毛細血管拡張性運動失調症の原因遺伝子であるATM(ataxia-telangiectasia mutated)のスプライシングの補正効率を飛躍的に向上させることができる56).また,モデルマウスにおいてフルオレセインイソチオシアネート(FITC)で標識した(RXRRBR)2XB-AMOは脳への効率的な取り込みを示している.
siRNAの送達およびスプライシング補正という手法に加えて,アンチセンスオリゴヌクレオチド,ペプチド核酸(peptide nucleic acid:PNA),およびデコイDNAといった核酸の送達にもCPPを利用することができる.Cailleらは,アンチセンスオリゴヌクレオチドとペネトラチンを融合したペネトラチン-APPが成体マウスの脳室下帯においてAPP発現および胚性神経幹細胞の増殖を減少させたことを実証している57).
デコイDNAは人工的な二本鎖DNAからなり,特定の転写因子を不活性化するプロモーター配列を模倣するように設計された58)が,そのバイオアベイラビリティは乏しく必ずしも治療用核酸としての有用性があるとはいい難かった.FisherらはTP/TP10-PNAの六量体または九量体と,NFκBデコイDNAを結合させることでインターロイキン1誘導性のNFκB活性化およびインターロイキン6の遺伝子発現を効率的に抑制できることを証明している59).
4)CPPによる小分子薬剤の送達
BBBを通過する化学療法剤などの小分子を中枢神経へ送達するためにもCPPは利用されており(表3),特にSynBペプチドとAngiopepについては,このような薬剤を脳へ送達する手段としてよく研究が進んでいる.
表3 小分子薬剤を送達するCPP| CPP,アミノ酸配列 | 送達する物質 | 標 的 | 備 考 |
|---|
| SynB1/SynB3, RGGRLSYSRRRFSTSTGR/RRLSYSRRRF | ダラルギン | 脳実質 | ダラルギンの脳への取り込みが亢進することにより,鎮痛作用が向上する60) |
| SynB1/D-ペネトラチン,RGGRLSYSRRRFSTSTGR/RQIKIWFQNRRMKWKK | ドキソルビシン | 脳実質 | SynB1やD-ペネトラチンと融合することで脳へのドキソルビシンの取り込みが増強される62) |
| Angiopep-5, RFFYGGSRGKRNNFRTEEY | ドキソルビシン | 神経膠芽腫細胞株,脳実質 | Angiopep-5-ドキソルビシンは神経膠芽腫細胞株を効率的に死滅させ,マウスでは速やかに脳実質に移行する64) |
| Angiopep-2-O-MWNTs-PEG, PFFYGGSGGNRNNYLREEY-O-MWNTs-PEG | ドキソルビシン | 神経膠腫 | Angiopep-2-O-MWNTs-PEGは神経膠腫のLRP受容体を標的とし,効率的にドキソルビシンを送達できる65) |
| Angiopep-2, PFFYGGSGGNRNNYLREEY | パクリタキセル | 脳への転移がん | Angiopep-2-パクリタキセルは脳転移したがんへの治療効果を示す66) |
SynBペプチドファミリーと薬剤を結合させて投与することにより,脳に到達する薬剤を増加させる報告がいくつも示されている.Rousselleらは,ドキソルビシン,ベンジルペニシリン,パクリタキセル,ダラルギンといった脳への透過性の乏しい種々の薬剤をSynB1またはSynB3にコンジュゲートし,それらをマウスに静脈内注射した際に大幅に脳への到達率が向上することを報告している60).また,DrinらはSynB1とSynB5が脳内へのドキソルビシンの取り込みを大幅に増加させることを報告した61).また,ドキソルビシンにSynB1やペネトラチンを共有結合させることにより,ラットにおいて脳への輸送能が最大30倍増加することも確認されている62).
天然のタンパク質由来のペプチドファミリーに含まれるAngiopepは,in vitro BBBモデルおよびin vivoでの試験で薬剤を高効率で脳に送達するために使用されてきた.DemeuleらはAngiopep-2がAlexa488で標識したパクリタキセルを輸送し,BBBを通過して脳のがんを治療できることを報告した63).Angiopep-5と,3分子のドキソルビシンを結合したANG1007は,in vitroではがん細胞株を死滅させ,マウスを用いた実験では非常に効率的にBBBを通過することが確認されている64).近年,薬剤やナノ粒子をCNSへ送達するためにAngiopepを使用する研究が多くなされており,Angiopepで修飾した分子により脳腫瘍やがんの脳転移をターゲティングすることは有望視される治療法の一つである65, 66).
多くの研究がCPPの生体への投与を静脈内注射で行っている中,TAT修飾ミセルを鼻腔内投与し,鼻粘膜を介して脳への送達を行っている研究もある67).これらは臨床応用を考えた際により低侵襲な方法であり,CPPの優位性を示すものだといえる.
5)CPPによるナノ粒子の送達
ナノ粒子は1~100 nmサイズの人工的な微粒子である.ナノ粒子はバルク(一般的なサイズ・個体)の状態とは異なる物性を示すため,その特性を生かすための研究が進められているが医療分野への応用もその例外ではない.
Santraらは硫化カドミウム,マンガン,硫化亜鉛からなる量子ドットとTATをコンジュゲートし,それらをラットの頸動脈から注入した際に脳血管の内皮細胞を通過し脳実質に移行することを明らかにしている68).TAT-PEG-β-コレステロールは自己組織化によりナノ粒子のミセルを形成するが,これはin vitroにおいてヒト脳内皮細胞へ容易に取り込まれることが確認されている69).さらにこのナノ粒子は,BBBを通過し,神経細胞の核にまで移行することができることが併せて報告されている.WangらはCryptococcus neoformans感染によるウサギの髄膜炎モデルにおいて,ナノ粒子であるTAT-コレステロール-G3R6がBBBを横断し,脳組織中において抗菌活性を示すことを報告している70).
なおTATで修飾したリポソームの多くは,選択的に脳をターゲットとしていないにも関わらず,その多くが尾静脈からの投与後24時間以内に脳に蓄積するという報告もある71).これらの研究は,脳の感染症の治療や生体でのナノ粒子の追跡,またCNS関連疾患の治療やモニタリングのためにTATによってナノ粒子の輸送を補助することの重要性を表しており,臨床応用可能なナノキャリアの開発の可能性を示している.
TATに加え,正常な脳における薬物送達のために使用されているCPPも存在する.たとえば二官能性PEGを介したポリアミドアミン(polyamidoamine:PAMAM)とAngiopep-2の複合体に,DNAを結合させたPAMAM-PEG-Angiopep/DNAというナノ粒子は,神経膠腫の遺伝子治療のための新規の送達システムとなる可能性を秘めている72)(表4).
表4 ナノ粒子を送達するCPP| CPP,アミノ酸配列 | 送達する物質 | 標 的 | 備 考 |
|---|
| PEI-TAT, YGRKKRRQRRR-PEI | プラスミドDNA | 初代培養ニューロン | PEI-DNA-TATは初代培養ニューロンへのトランスフェクション効率を向上させる47) |
| (RXRRBR)2XB, RXRRBRRXRRBRXB | AMO | 毛細血管拡張性運動失調症 | (RXRRBR)2XB-AMOはマウスの尾静脈からの投与後,脳内に移行しATMスプライシングの補正を行う56) |
| TAT-PEG-コレステロール,YGRKKRRQRRR-PEG-コレステロール | FITC | 海馬 | FITC-TAT-PEG-コレステロールはBBBを通過しラットの海馬まで到達する69) |
| PAMAM-PEG-Angiopep-2, PFFYGGSGGNRNNYLREEY | プラスミドDNA | 脳毛細血管内皮細胞 | PAMAM-PEG-Angiopep-2-DNAはBBBを通過し脳内に到達する72) |
| CAQK, CAQK | 銀ナノ粒子 | 外傷性脳損傷 | 尾静脈より投与されたCAQK-NPsはマウスの外傷洗脳損傷部位に停滞する73) |
また,最近では外傷性脳損傷をターゲットとしたわずか4アミノ酸からなるCAQKというペプチドも発見されている73).CAQKに銀ナノ粒子を結合したCAQK-NPsは,脳内の炎症を起こした部分のみに停滞することが報告されている.なお,これは損傷を起こした神経そのものよりは,その周囲を取り巻くペリニューロナルネットの損傷を認識しているようである.
さらにナノ粒子からは少し話が逸れるが,長さ10 µmのシリコンナノワイヤー(silicon nanowire:Si NW)の表面にTATを複数結合させることにより,マウスの初代培養神経細胞にこのワイヤーを移入するという報告もある74).実験に用いられたニューロンの細胞体がおよそ20 µmであるため,巨大な物質の細胞内導入にもCPPが応用できることを示している.
引用文献References
1) Chen, Y. & Liu, L. (2012) Adv. Drug Deliv. Rev., 64, 640–665.
2) Abbott, N.J. (2005) Cell. Mol. Neurobiol., 25, 5–23.
3) Pardridge, W. (1998) J. Neurochem., 70, 1781–1792.
4) Wong, H.L., Wu, X.Y., & Bendayan, R. (2012) Adv. Drug Deliv. Rev., 64, 686–700.
5) Hawkins, B.T. & Davis, T.P. (2005) Pharmacol. Rev., 57, 173–185.
6) Weksler, B.B., Subileau, E.A., Perrière, N., Charneau, P., Holloway, K., Leveque, M., Tricoire-Leignel, H., Nicotra, A., Bourdoulous, S., Turowski, P., Male, D.K., Roux, F., Greenwood, J., Romero, I.A., & Couraud, P.O. (2005) FASEB J., 19, 1872–1874.
7) Abbott, N.J. (2002) J. Anat., 200, 629–638.
8) Pardridge, W.M. (2003) Mol. Interv., 3, 90–105.
9) Persidsky, Y., Ramirez, S.H., Haorah, J., & Kanmogne, G.D. (2006) J. Neuroimmune Pharmacol., 1, 223–236.
10) Ramsauer, M., Kunz, J., Krause, D., & Dermietzel, R. (1998) J. Cereb. Blood Flow Metab., 18, 1270–1281.
11) Ramsauer, M., Krause, D., & Dermietzel, R. (2002) FASEB J., 16, 1274–1276.
12) Dohgu, S., Takata, F., Yamauchi, A., Nakagawa, S., Egawa, T., Naito, M., Tsuruo, T., Sawada, Y., Niwa, M., & Kataoka, Y. (2005) Brain Res., 1038, 208–215.
13) Pardridge, W.M. (2005) Mol. Biotechnol., 30, 57–70.
14) Bendayan, R., Lee, G., & Bendayan, M. (2002) Microsc. Res. Tech., 57, 365–380.
15) Deeken, J.F. & Löscher, W. (2007) Clin. Cancer Res., 13, 1663–1674.
16) Ronaldson, P.T., Persidsky, Y., & Bendayan, R. (2008) Glia, 56, 1711–1735.
17) Wekerle, H. (2002) Trends Neurosci., 186, 140–144.
18) Zou, L.L., Ma, J.L., Wang, T., Yang, T.B., & Liu, C.B. (2013) Curr. Neuropharmacol., 11, 197–208.
19) Derossi, D., Joliot, A.H., Chassaing, G., & Prochiantz, A. (1994) J. Biol. Chem., 269, 10444–10450.
20) Mäe, M. & Langel, Ü. (2006) Curr. Opin. Pharmacol., 6, 509–514.
21) Vives, E., Brodin, P., & Lebleu, B. (1997) J. Biol. Chem., 272, 16010–16017.
22) Pooga, M., Hällbrink, M., Zorko, M., & Langel, U. (1998) FASEB J., 12, 67–77.
23) Rothbard, J.B., Garlington, S., Lin, Q., Kirschberg, T., Kreider, E., McGrane, P.L., Wender, P.A., & Khavari, P.A. (2000) Nat. Med., 6, 1253–1257.
24) Heitz, F., Morris, M.C., & Divita, G. (2009) Br. J. Pharmacol., 157, 195–206.
25) Fonseca, S.B., Pereira, M.P., & Kelley, S.O. (2009) Adv. Drug Deliv. Rev., 61, 953–964.
26) Gallo, G. (2003) Methods Cell Biol., 71, 325–338.
27) Kumar, P., Wu, H., McBride, J.L., Jung, K.E., Kim, M.H., Davidson, B.L., Lee, S.K., Shankar, P., & Manjunath, N. (2007) Nature, 448, 39–43.
28) Cai, B., Lin, Y., Xue, X.H., Fang, L., Wang, N., & Wu, Z.Y. (2011) Exp. Neurol., 227, 224–231.
29) Luo, D. & Saltzman, W.M. (2000) Nat. Biotechnol., 8, 33–37.
30) Herce, H.D. & Garcia, A.E. (2007) J. Biol. Phys., 33, 345–356.
31) Lundberg, M. & Johansson, M. (2001) Nat. Biotechnol., 19, 713–714.
32) Frankel, A.D. & Pabo, C.O. (1988) Cell, 55, 1189–1193.
33) Plénat, T., Deshayes, S., Boichot, S., Milhiet, P.E., Cole, R.B., Heitz, F., & Le Grimellec, C. (2004) Langmuir, 20, 9255–9261.
34) Deshayes, S., Gerbal-Chaloin, S., Morris, M.C., Aldrian-Herrada, G., Charnet, P., Divita, G., & Heitz, F. (2004) Biochim. Biophys. Acta, 1667, 141–147.
35) Theisen, D.M., Pongratz, C., Wiegmann, K., Rivero, F., Krut, O., & Krönke, M. (2006) Vaccine, 24, 3127–3136.
36) Schwarze, S.R., Ho, A., Vocero-Akbani, A., & Dowdy, S.F. (1999) Science, 285, 1569–1572.
37) Cao, G., Pei, W., Ge, H., Liang, Q., Luo, Y., Sharp, F.R., Lu, A., Ran, R., Graham, S.H., & Chen, J. (2002) J. Neurosci., 22, 5423–5431.
38) Hirt, L., Badaut, J., Thevenet, J., Granziera, C., Regli, L., Maurer, F., Bonny, C., & Bogousslavsky, J. (2004) Stroke, 35, 1738–1743.
39) Aarts, M., Liu, Y., Liu, L., Besshoh, S., Arundine, M., Gurd, J.W., Wang, Y.T., Salter, M.W., & Tymianski, M. (2002) Science, 298, 846–850.
40) Kilic, E., Kilic, U., & Hermann, D.M. (2005) CNS Drug Rev., 11, 369–378.
41) Fu, A., Wang, Y., Zhan, L., & Zhou, R. (2012) Pharm. Res., 29, 1562–1569.
42) Lim, S., Kim, W.-J., Kim, Y.-H., Lee, S., Koo, J.-H., Lee, J.-A., Yoon, H., Kim, D.-H., Park, H.-J., Kim, H.-M., Lee, H.-G., Yun Kim, J., Lee, J.-U., Hun Shin, J., Kyun Kim, L., Doh, J., Kim, H., Lee, S.-K., Bothwell, A.L.M., Suh, M., & Choi, J.-M. (2015) Nat. Commun., 6, 8244.
43) Liu, Z., Li, M., Cui, D., & Fei, J. (2005) J. Control. Release, 102, 699–710.
44) Rudolph, C., Plank, C., Lausier, J., Schillinger, U., Müller, R.H., & Rosenecker, J. (2003) J. Biol. Chem., 278, 11411–11418.
45) Knight, A., Carvajal, J., Schneider, H., Coutelle, C., Chamberlain, S., & Fairweather, N. (1999) Eur. J. Biochem., 259, 762–769.
46) Lo, S.L. & Wang, S. (2008) Biomaterials, 29, 2408–2414.
47) Suk, J.S., Suh, J., Choy, K., Lai, S.K., Fu, J., & Hanes, J. (2006) Biomaterials, 27, 5143–5150.
48) Eguchi, A., Meade, B.R., Chang, Y.C., Fredrickson, C.T., Willert, K., Puri, N., & Dowdy, S.F. (2009) Nat. Biotechnol., 27, 567–571.
49) Meade, B.R. & Dowdy, S.F. (2008) Adv. Drug Deliv. Rev., 60, 530–536.
50) Said Hassane, F., Saleh, A.F., Abes, R., Gait, M.J., & Lebleu, B. (2010) Cell. Mol. Life Sci., 67, 715–726.
51) Ralph, G.S., Mazarakis, N.D., & Azzouz, M. (2005) J. Mol. Med. (Berl.), 83, 413–419.
52) Alvarez-Erviti, L., Seow, Y., Yin, H., Betts, C., Lakhal, S., & Wood, M.J. (2011) Nat. Biotechnol., 29, 3–4.
53) Hwang, D.W., Son, S., Jang, J., Youn, H., Lee, S., Lee, D., Lee, Y.S., Jeong, J.M., Kim, W.J., & Lee, D.S. (2011) Biomaterials, 32, 4968–4975.
54) Davidson, T.J., Harel, S., Arboleda, V.A., Prunell, G.F., Shelanski, M.L., Greene, L.A., & Troy, C.M. (2004) J. Neurosci., 24, 10040–10046.
55) Corey, D.R. & Abrams, J.M. (2001) Genome Biol., 2, 1015.1–1015.3.
56) Du, L., Kayali, R., Bertoni, C., Fike, F., Hu, H., Iversen, P.L., & Gatti, R.A. (2011) Hum. Mol. Genet., 20, 3151–3160.
57) Caille, I., Allinquant, B., Dupont, E., Bouillot, C., Langer, A., Muller, U., & Prochiantz, A. (2004) Development, 131, 2173–2181.
58) Morishita, R., Gibbons, G.H., Horiuchi, M., Ellison, K.E., Nakama, M., Zhang, L., Kaneda, Y., Ogihara, T., & Dzau, V.J. (1995) Proc. Natl. Acad. Sci. USA, 92, 5855–5859.
59) Fisher, L., Soomets, U., Cortés Toro, V., Chilton, L., Jiang, Y., Langel, U., & Iverfeldt, K. (2004) Gene Ther., 11, 1264–1272.
60) Rousselle, C., Clair, P., Smirnova, M., Kolesnikov, Y., Pasternak, G.W., Rees, A.R., Scherrmann, J., Temsamani, J., Scientifique, P., & Besse, G. (2003) J. Pharmacol. Exp. Ther., 306, 371–376.
61) Drin, G., Cottin, S., Blanc, E., Rees, A.R., & Temsamani, J. (2003) J. Biol. Chem., 278, 31192–31201.
62) Rousselle, C., Clair, P., Lefauconnier, J.M.M., Kaczorek, M., Scherrmann, J.M.M., & Temsamani, J. (2000) Mol. Pharmacol., 57, 679–686.
63) Demeule, M., Currie, J.C., Bertrand, Y., Ché, C., Nguyen, T., Régina, A., Gabathuler, R., Castaigne, J.P., & Béliveau, R. (2008) J. Neurochem., 106, 1534–1544.
64) Ché, C., Yang, G., Thiot, C., Lacoste, M.C., Currie, J.C., Demeule, M., Régina, A., Béliveau, R., & Castaigne, J.P. (2010) J. Med. Chem., 53, 2814–2824.
65) Ren, J., Shen, S., Wang, D., Xi, Z., Guo, L., Pang, Z., Qian, Y., Sun, X., & Jiang, X. (2012) Biomaterials, 33, 3324–3333.
66) Kurzrock, R., Gabrail, N., Chandhasin, C., Moulder, S., Smith, C., Brenner, A., Sankhala, K., Mita, A., Elian, K., Bouchard, D., & Sarantopoulos, J. (2012) Mol. Cancer Ther., 11, 308–316.
67) Kanazawa, T., Taki, H., Tanaka, K., Takashima, Y., & Okada, H. (2011) Pharm. Res., 28, 2130–2139.
68) Santra, S., Yang, H., Holloway, P.H., Stanley, J.T., & Mericle, R.A. (2005) J. Am. Chem. Soc., 127, 1656–1657.
69) Liu, L., Venkatraman, S.S., Yang, Y.Y., Guo, K., Lu, J., He, B., Moochhala, S., & Kan, L. (2008) Biopolym. Pept. Sci. Sect., 90, 617–623.
70) Wang, H., Xu, K., Liu, L., Tan, J.P.K., Chen, Y., Li, Y., Fan, W., Wei, Z., Sheng, J., Yang, Y.Y., & Li, L. (2010) Biomaterials, 31, 2874–2881.
71) Qin, Y., Chen, H., Zhang, Q., Wang, X., Yuan, W., Kuai, R., Tang, J., Zhang, L., Zhang, Z., Zhang, Q., Liu, J., & He, Q. (2011) Int. J. Pharm., 420, 304–312.
72) Ke, W., Shao, K., Huang, R., Han, L., Liu, Y., Li, J., Kuang, Y., Ye, L., Lou, J., & Jiang, C. (2009) Biomaterials, 30, 6976–6985.
73) Mann, A.P., Scodeller, P., Hussain, S., Joo, J., Kwon, E., & Gary, B. (2016) Nat. Commun., 7, 1–11.
74) Lee, J.H., Zhang, A., You, S.S., & Lieber, C.M. (2016) Nano Lett., 16, 1509–1513.
75) Matsushita, M. & Matsui, H. (2005) J. Mol. Med. (Berl.), 83, 324–328.
76) Higa, M., Katagiri, C., Shimizu-Okabe, C., Tsumuraya, T., Sunagawa, M., Nakamura, M., Ishiuchi, S., Takayama, C., Kondo, E., & Matsushita, M. (2015) Biochem. Biophys. Res. Commun., 457, 206–212.
77) Ohgaki, H. & Kleihues, P. (2007) Am. J. Pathol., 170, 1445–1453.