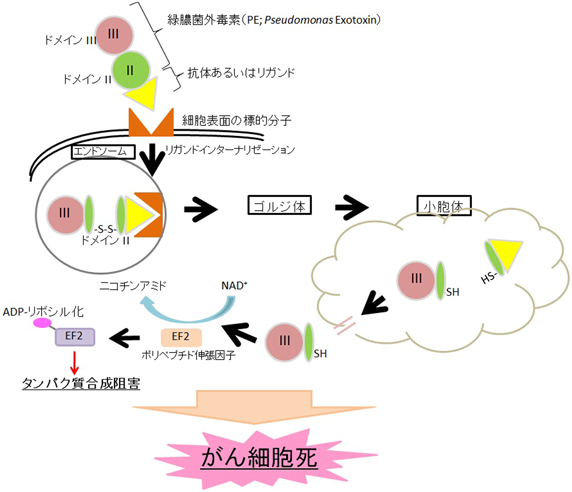
わが国において現在死亡原因の1位である「がん」1)は,今後,2人に1人ががんになり,3人に1人ががんで死亡するとも予想されている.このがんの標準治療の実施においては,がん細胞や患者の体質により,治療法の質と量を選択する必要がある.がんの化学療法においては,従来からがん細胞の耐性獲得による治療抵抗性の問題を抱えており,この問題点を克服すべく,1980年代後半に,米国国立がん研究所のPastanらにより,“殺細胞型”分子標的薬であり,“魔法の弾丸(Magic Bullet)”と呼ばれることになるイムノトキシンの研究開発が行われた2).このイムノトキシンは,がん細胞特異的な受容体等を介して取り込まれる弾頭部分とがん細胞を殺す爆薬部分からなり,ミサイル型キメラタンパク質の分子標的抗がん剤である(図1).このイムノトキシンの弾頭部分には上皮成長因子受容体(epidermal growth factor receptor:EGFR)に対するリガンド(EGF)やインターロイキン(interleukin:IL)4あるいは13,さらには,これら受容体に対する抗体(モノクローナル,単鎖抗体など)が用いられ,爆薬部分には緑膿菌外毒素(Pseudomonas exotoxin:PE)やジフテリア毒素(diphtheria toxin:DT)が使用されたタンパク質製剤が研究開発の中心であった3, 4)(図1).2000年代に入り,川上らは,米国連邦政府食品医薬品局において,難治性がんに対するイムノトキシン療法の研究開発に積極的に携わり,IL4-PEが膵臓がん,胆肝がんなどに対して5, 6),IL13-PEが,頭頸部がんおよび悪性脳腫瘍などに対して7, 8),効果的な抗腫瘍効果を発揮することを示した.特に,IL13受容体α2を標的としたIL13-PEは,悪性脳腫瘍である膠芽腫(glioblastoma:GBM)に対して米国で第III相試験(Phase III)まで施行されたが,アルキル化剤のギリアデル(Gliadel wafers)とのランダム化比較試験において,残念ながら有意な差異はみられなかった9).イムノトキシンのようなタンパク質製剤は,(i)分子量が大きく固形がんに侵入しにくい,(ii)爆薬毒素部分に対して免疫原性が高く,中和抗体の産生,さらには,(iii)肝毒性等の問題点を有しているため,これらの問題点を解決する次世代の分子標的薬の開発が必須であると考えられる.
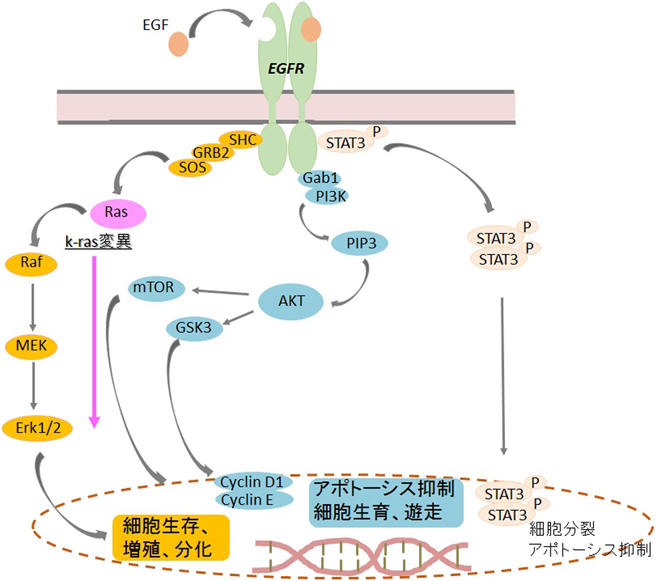
また,近年盛んに臨床の現場で用いられ研究開発が進んでいるチロシンキナーゼ阻害型分子標的抗がん剤(tyrosine kinase inhibitor:TKI)においても,これらの多くは,EGFRやその下流のシグナル伝達(図2)に重要なチロシンキナーゼを阻害する作用機序であるため,シグナル分子の変異により治療抵抗性・薬剤耐性の問題を有する10).k-ras変異は,これらTKIに対する薬剤耐性に関して最もよく知られたシグナル分子の変異の一つであり,非小細胞肺がんおよび進行性大腸がんの患者に対してEGFR標的TKIだけでなく,セツキシマブのようなEGFR標的抗体においても,その反応不良性との有意な相関が報告されている11).
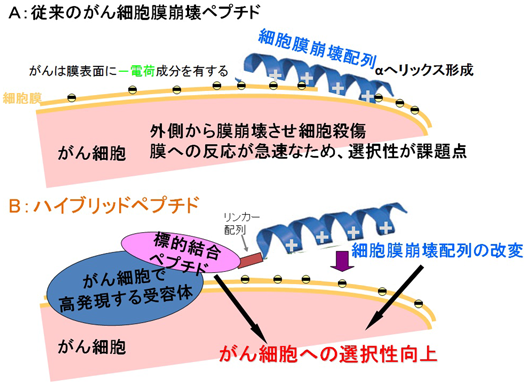
一方,1987年に米国国立衛生研究所のZasloffによってカエルの皮膚より単離,同定された二つの抗菌性ペプチド(magainin 1および2)の発表12)以降,現在までに多くの抗菌性ペプチドがヒトを含むさまざまな動物から単離され,そのアミノ酸配列,構造,および作用機構に関して多くの研究がなされてきた13, 14).これら多くの抗菌性ペプチドは,カチオン性および両親媒性のアミノ酸を多く含むことが知られており13, 14),負電荷を有する細菌膜と接触することでその膜を崩壊させるモデル(Shai–Matsuzaki–Huangモデル)が抗菌活性のメカニズムの一つとして提唱されている15).Shaiらは,近年,細菌膜の負電荷の特徴とがん細胞膜(細胞表面に負電荷を有する)との類似点に着目し,これら抗菌性ペプチドの特徴を用いた人工的な膜崩壊型ペプチド(lytic peptide)をいくつか設計し,これらペプチドががん細胞に対する殺細胞効果および抗腫瘍効果を有することを見いだした16–18).近年,ペプチドはその合成技術の向上から安価に迅速に合成でき,また,ファージディスプレイ法19, 20)との組合わせにより,標的ペプチドの迅速なスクリーニングが可能である.このため,医薬品開発におけるin vitroの試験からin vivoの有効性,毒性,薬物動態といった試験ステージが上ってから判明する問題点等を迅速にフィードバックできることが期待される.以上の経緯を踏まえ,がん化学療法における問題点の克服のために,我々は組換えタンパク質製剤から,ペプチドを用いた新たながん分子標的薬の研究開発へ転換することにした.
2. イムノトキシンからハイブリッドペプチドへの転換
我々は,イムノトキシンからの転換において,まず,がん細胞膜を直接崩壊させる膜崩壊型ペプチドに着目し,標的ペプチド(弾頭部分)を組み合わせるのに最適かつ,がん細胞選択的な膜崩壊型ペプチドK8L9を見いだした21)(図3).K8L9膜崩壊型ペプチドは,リンカー配列を挿入することで,標的ペプチドとの組合わせによりがん細胞への選択性および殺細胞効果が増強することが確認され,我々は,“ハイブリッドペプチド”(ハイブリッドとは,二つまたそれ以上のものを組み合わせることで一つの目的をなすものを指す)と命名することとした21)(図3).この膜崩壊型ペプチドを用いることで,以下がん細胞において特異的,あるいは発現上昇している受容体を標的としたハイブリッドペプチドを設計し,評価を行った.
1)EGFR標的化ハイブリッドペプチド
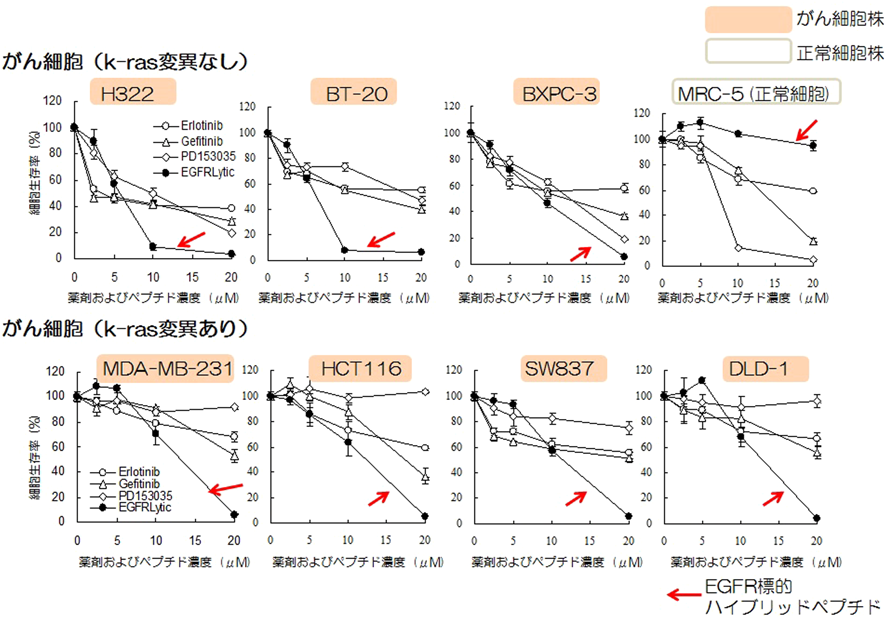
EGFR(ErbB1/Her1)は170 kDaの細胞表面受容体タンパク質であり,チロシンキナーゼのErbBファミリーに属し,細胞の増殖,分化,遊走において重要な役割を担う22).この受容体を介するシグナル伝達はがん細胞の増殖を引き起こし,さらには,がん細胞の運動性および血管形成を増強する方向に働くことが知られている23).EGFRの発現上昇は乳がん,肺がん,胃がん,大腸がん,前立腺がん,膵臓がん,および卵巣がんを含むヒトの上皮由来の多くの固形がんで幅広く見いだされており24),このためEGFRはがん化学療法のための重要ながん細胞特異的な標的候補としてこれまでに盛んに研究されてきた25, 26).そこで,EGFRを標的とした結合ペプチド(ファージディスプレイライブラリーより単離)27)を用いて膜崩壊型K8L9ペプチドと組み合わせたEGFR-lyticハイブリッドペプチドを設計し評価を行った.in vitroにおける殺細胞効果を検討したところ,膜崩壊型K8L9単独と比べてハイブリッドペプチドは急速かつ低濃度において十分な殺細胞効果を発揮すること,ハイブリッド化することによる殺細胞効果の増強がEGFRの発現量と相関することが確認された21).この殺細胞効果は,特に,TKI治療抵抗性の原因の一つとして知られているk-ras変異を有する各種がん細胞株(MDA-MB-231, HCT116, SW837,およびDLD-1)に対しても効果を発揮するが,正常細胞株(MRC-5)に対しては同濃度において殺細胞効果を示さないことが確認された.一方,エルロチニブ,ゲフィチニブおよびPD153035などのTKIは,k-ras変異がない各種がん細胞株(H322, BT-20, BXPC-3)および正常細胞株に対して殺細胞効果を示したが,上記,k-ras変異を有するがん細胞株には反応が低下することが確認された21)(図4).ヒトがん細胞株を用いたin vivoにおけるマウス異種移植担がんモデルでは,ハイブリッドペプチドは週3回,3週間(合計9回)の尾静脈内投与によりk-ras変異なし,k-ras変異ありの両方のがん細胞株に対しても効果的な抗腫瘍効果を発揮することが確認された21).以上の結果から,EGFRを標的としたハイブリッドペプチドは,弾頭部分はがん細胞に特異的に発現している受容体を標的としているが,膜崩壊型ペプチドによるがん細胞膜を直接的に崩壊させるペプチドであるため,がん細胞内のシグナル伝達に異常が生じることで獲得した薬剤耐性に対しても効果を発揮することが考えられ,薬剤耐性の問題点を克服することが期待される.さらに我々は,このEGFR標的ハイブリッドペプチドのさらなる効果増強を目的として,標的部分(弾頭部分)のペプチドのアミノ酸改変を行うことで,in vitroにおける殺細胞効果およびin vivoにおける抗腫瘍効果が増強されたハイブリッドペプチドを見いだすことに成功している28).また,我々は,EGFR以外にもがん細胞において標的となりうる受容体に対してハイブリッドペプチドを設計し,その効果を評価した.
2)その他の標的候補
a. TfR標的化ハイブリッドペプチド
トランスフェリン受容体(transferrin receptor:TfR)は95 kDaの細胞膜貫通型糖タンパク質であり,二つのサブユニットが二つのジスルフィド結合を形成した構造を持ち,細胞内への鉄の取り込みおよび細胞の成育に重要な役割を担う受容体である29).鉄は,細胞内における代謝やDNA合成を含むさまざまな工程に必要とされるヘムタンパク質などのコファクターとして必要不可欠であり30),正常組織と比較して乳がん,膵臓がん,肺がん,非ホジキンリンパ腫,悪性脳腫瘍においてTfRの発現上昇が見受けられること29),TfRの発現上昇と腫瘍のグレード,ステージあるいは予後との相関があること31, 32)から,TfRはがんの治療標的として有用であると考えられている29).TfRを標的とした結合ペプチド(ファージディスプレイライブラリーより単離)33)と膜崩壊型K8L9ペプチドを組み合わせたTfR-lyticハイブリッドペプチドは,in vitroにおいてTfR高発現ヒト乳がん細胞株(T47D, BT474およびMDA-MB-231など)に対して効果的な殺細胞効果,さらには,in vivoにおいてMDA-MB-231を用いたマウス異種移植担がんモデルに対して抗腫瘍効果を発揮することが確認された34).
b. Her2標的化ハイブリッドペプチド
Her2(human epidermal growth factor receptor 2, Her2/ErbB2)は膜貫通型タンパク質であり,ErbBファミリーに属するが,唯一このファミリーにおいて特定のリガンドがわかっておらず,他のErbBファミリーの受容体とヘテロ二量体を形成することが報告されている35, 36).一方,乳がんの患者数は近年増加の一途をたどっており,このHer2は,乳がんの20%から30%において高発現していること,またその発現量と予後不良との相関が報告されている37, 38).Her2を標的とした結合ペプチド(ファージディスプレイライブラリーより単離)39)を同様にK8L9ペプチドと組み合わせたHer2-lyticハイブリッドペプチドは,in vitroにおいてHer2高発現ヒト乳がん細胞株(MDA-MB-361, MDA-MB-453およびBT-474など)に対して効果的な殺細胞効果,さらには,in vivoにおいてHer2を標的とした,モノクローナル抗体(トラスツズマブ)およびTKI(ラパチニブ)両方に耐性な乳がん細胞株を用いたマウス異種移植担がんモデルに対しても抗腫瘍効果を発揮することが確認された40).
c. IL4Rα標的化ハイブリッドペプチド
IL-4受容体α(IL4Rα)は,サイトカインIL-4と高い親和性を有する140 kDaの膜貫通型タンパク質である41).三つの異なるタイプ(Type I~III)からなり42),Type IはIL4Rαおよびcommon γ chain(γc)と,Type IIはIL4RαおよびIL13 Rα1と,Type IIIはIL4Rα, IL13 Rα1およびγcとそれぞれ複合体を形成する形で存在する42).腎臓がん,乳がん,卵巣がん,悪性脳腫瘍を含む固形がんにおいて,IL4RαはType IIとして存在し,その発現上昇が報告されている42, 43).IL-4とIL4Rαの相互作用に重要なアミノ酸配列を基に設計したIL4Rα標的ペプチドをK8L9ペプチドと組み合わせたIL4Rα-lyticハイブリッドペプチドは,in vitroにおいてIL4Rαが高発現している膵臓がん細胞株(BXPC-3およびSU.86.86.),悪性脳腫瘍細胞株(T98GおよびA172),乳がん細胞株(MDA-MB-231)に対する殺細胞効果,およびin vivoにおいてBXPC-3を用いたマウス異種移植担がんモデルに対する抗腫瘍効果を発揮することが確認された44).
我々はその他にも,IL-13受容体α2(IL13Rα2)やニューロピリン-1(neuropilin-1:NRP-1)を標的としたハイブリッドペプチドをそれぞれ設計し,これら受容体が高発現しているがん細胞株に対する殺細胞効果を有することも確認している.特に,IL13Rα2は,その発現上昇が難治性がんの一つである膠芽腫において報告されており45),この受容体の治療標的としての有用性も示唆されていることから46),IL13Rα2標的化ハイブリッドペプチドは,悪性脳腫瘍に対する新たな抗がん分子標的薬の候補として期待できるかもしれない.このように,ハイブリッドペプチドは標的(弾頭)部分のペプチドをがん細胞の目的受容体に対して選択することで,それぞれのがん細胞の性質に応じて効果的にがん細胞を殺傷することが期待できる.
3)免疫原性
我々は,TfR標的化ハイブリッドペプチドを用いて,ハイブリッドペプチド投与に対する特異的な抗体が産生されるかどうかの検討を行った.マウスの悪性脳腫瘍細胞株GL261をC57BL/6マウスに移植した系を用いて,生理食塩水,TfR-lyticハイブリッドペプチド,およびキャリアタンパク質であるキーホールリンペットヘモシアニン(keyhole limpet hemocyanin:KLH)と結合させたTfR-lyticをそれぞれ投与後,血清中のハイブリッドペプチドに特異的なIgGを調べたところ,KLH結合TfR-lyticでは特異的な抗体の産生が見受けられたが,TfR-lyticのみの投与においては投与期間中および投与後も特異的な抗体の産生ならびに特異的なT細胞の誘導は見受けられなかった47).ハイブリッドペプチドは約30前後のアミノ酸からなり,モノクローナル抗体やイムノトキシンなどのタンパク質製剤に比べて分子量が小さいことも含め,免疫原性は低いと考えられる.
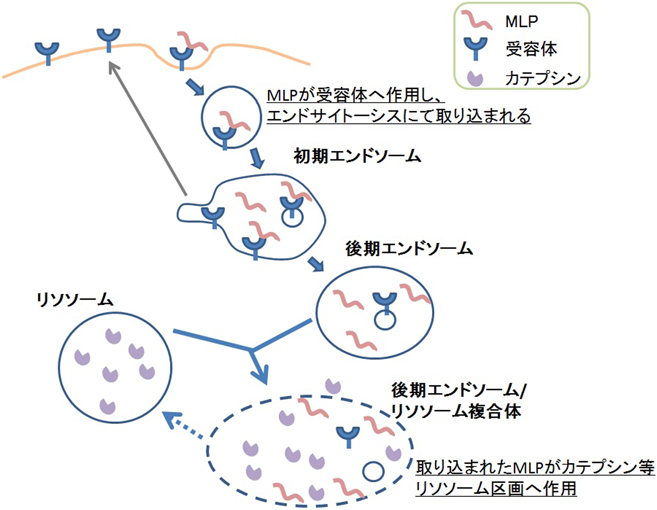
我々が改変したがん細胞膜崩壊型K8L9ペプチドの,がん細胞に対する作用機序について詳しく検討を行った.K8L9ペプチド等のカチオンリッチな細胞膜崩壊型ペプチド(membrane lytic peptide:MLP)は細胞膜に結合して崩壊させ細胞殺傷効果を示すが,その他の代表的な細胞膜に作用するカチオンリッチなペプチドである細胞膜透過性ペプチド(cell-penetrating peptide:CPP)48, 49),アミロイドβ50, 51)は受容体エンドサイトーシスを介して細胞内へ取り込まれることが知られている.我々はこれまでにK8L9ペプチドについても,低濃度曝露(低細胞毒性)の条件下では,エンドサイトーシス依存的および非依存的に細胞内へ取り込まれることを示した52).そこで,MLPについてもがん細胞への低濃度曝露条件下では,CPP,アミロイドβと同様に受容体エンドサイトーシスを介してがん細胞内へ入るのではないかと考え,その作用機構を解析した.さらにその細胞内動態についても解析した.
MLPとしてK8L9ペプチドとハチ毒成分のメリチンを用い,数種類のヒトがん細胞株におけるそれぞれの高発現受容体に着目した.K8L9ペプチドはエンドサイトーシス阻害剤であるサイトカラシンDおよびクロルプロマジンによって細胞内取り込みおよび殺細胞効果が低減された.低濃度のK8L9ペプチドおよびメリチンは高発現エンドサイトーシス受容体[TfR, LDL-related protein receptor1(LRP1),NRP-1]に作用して細胞内へ取り込まれ,その各受容体のノックダウンによって各ペプチドの殺細胞効果が抑制された.また,メリチンと相互作用する分子の一つとして免疫沈降法によってheat shock cognate protein 70(hsc70)を同定した.hsc70はK8L9ペプチドの細胞内取り込み,細胞内機能障害等への関与が示唆された.細胞内においてK8L9ペプチドはリソソーム膜等へ影響を与え,カテプシンBの細胞質内への遊離を促進した.
K8L9ペプチドとメリチンはがん細胞への低濃度曝露において,エンドサイトーシス受容体を介して細胞内へ侵入しリソソーム区画へ影響を与え,他の細胞膜に作用するカチオンリッチなペプチドと類似の細胞への挙動を示すことが示唆された53)(図5).
我々は,EGFRを標的としたハイブリッドペプチドに関して,臨床応用化に向けて現在,以下の取り組みを行っている.
1)DDS化の取り組み
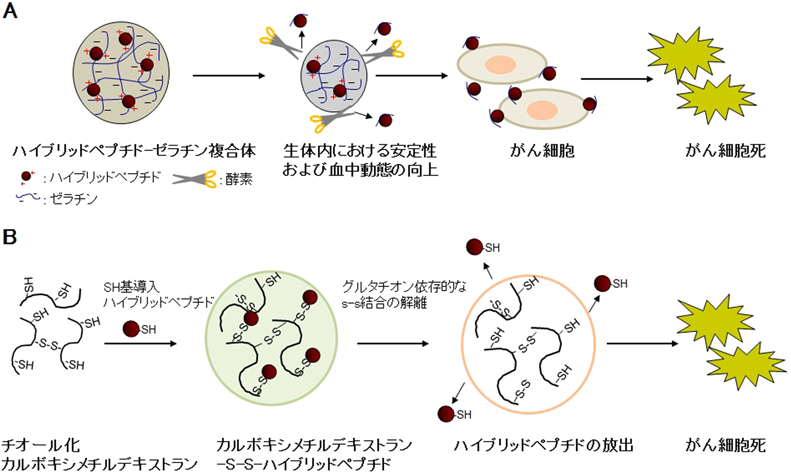
近年,抗がん剤に対してさまざまなドラッグデリバリーシステム(drug delivery system:DDS)が研究開発されており,既存の抗がん剤のさらなる効果増強および副作用軽減の観点からも注目を浴びている54–56).我々は,ハイブリッドペプチドのDDS化の取り組みとして,(a)生体吸収性ゼラチンハイドロゲルおよび(b)ジスルフィド結合を介したカルボキシメチルデキストランとの複合体を検討した(図6).
a. 生体吸収性ゼラチンハイドロゲルとハイブリッドペプチドとの複合体
生体吸収性ゼラチンハイドロゲルは動物の皮膚や骨を原料に作られるタンパク質であり,生体適合性が確認されている天然高分子材料である57).ハイブリッドペプチドの細胞膜崩壊部分であるK8L9は,カチオンリッチなため,アニオン性のゼラチンを用いて静電的相互作用を介したペプチドとゼラチン複合体を作製した.光散乱法によりこの複合体は負電荷を有する粒径100 nm以下の注射可能な製剤であることが確認され,in vitroにおいて,この複合体からのペプチドが溶媒中のウシ胎仔由来血清の濃度,時間依存的に放出されること,および,複合体のヒト膵臓がん細胞株BXPC-3に対する殺細胞効果は,この放出されるペプチド量に依存することが確認された.さらに,in vivoにおけるBXPC-3細胞を用いたマウス異種移植担がんモデルにおいてハイブリッドペプチド単体と比較して,この複合体ではペプチドの血中半減期が延長し,抗腫瘍効果が増強されることが示された58).
b. カルボキシメチルデキストランとハイブリッドペプチドとの複合体
グルタチオンは細胞内に高濃度に存在する抗酸化物質であり,細胞外のグルタチオン濃度に比べ,特にがん細胞内での濃度が数十~数百倍高い.このため,近年ジスルフィド結合を持つグルタチオン応答性の薬物キャリアーは抗がん剤の有用な送達ツールとして知られている59–61).チオール化カルボキシメチルデキストランとシステイン残基を導入したハイブリッドペプチドのジスルフィド結合(S–S)を介した複合体は,in vitroにおいてグルタチオン濃度依存的に還元されペプチドを放出することがわかった.また,in vivoにおけるマウス異種移植モデルではハイブリッドペプチド単体と比較してペプチドの血中半減期の延長,腫瘍集積性の改善および抗腫瘍効果の増強が確認された62).以上の結果から,ゼラチンハイドロゲルおよびチオールナノ粒子は,ハイブリッドペプチドの抗腫瘍効果を向上させるための有用なキャリアーであることが示唆された.
2)臨床応用を見据えた取り組み
我々は,ハイブリッドペプチドの臨床応用を見据えて,マウスを用いた大腸がん肝転移モデルにおけるハイブリッドペプチドの効果を検討した.肝転移は,大腸がんで最も見受けられる転移である63).ヌードマウスの脾臓にヒト大腸がん細胞株(HCT-116)を接種することで作製した肝転移モデルに対して,ハイブリッドペプチドの尾静脈からの投与により肝臓での腫瘍形成が抑制されること,さらにはコントロール(生理食塩水投与)群と比較して生存が延長することが確認された64).また,食道がんに対する新たな治療法の可能性として,食道がん細胞株およびマウス異種移植モデルを用いた検討も行い,in vitroにおいて抗がん剤5-フルオロウラシル(5-FU)に耐性な食道がん細胞株に対しても殺細胞効果およびin vivoにおける抗腫瘍効果を発揮すること,さらには,3次元培養を用いてハイブリッドペプチドが正常の食道組織に対して顕著な毒性を引き起こさないことを確認している65).食道がん細胞では,EGFRが高頻度で発現しており,その発現と予後不良との相関が確認されているが66, 67),現在,臨床の場で使用されている分子標的抗がん剤は限定されているため,ハイブリッドペプチドは新たな治療薬候補として期待できるかもしれない.
3)現在の取り組み
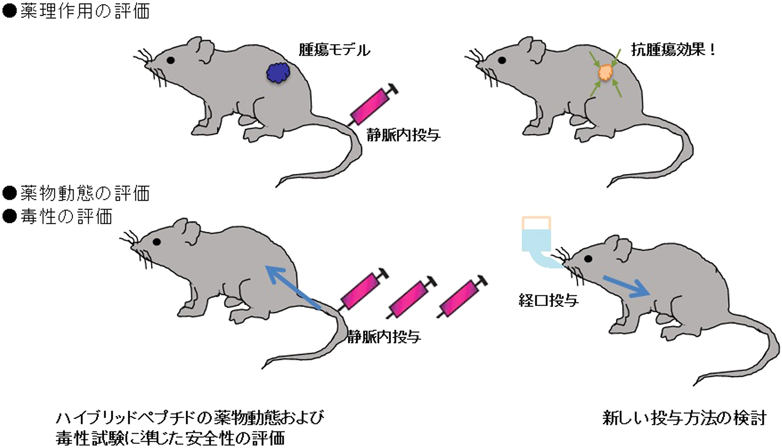
抗がん剤の臨床試験では,第I相試験より患者を対象とした投与が行われ68),既存治療が奏効しない進行がん患者に対して用量漸増法により安全性を確認しながら,最大耐用量(maximum tolerated dose:MTD)を見いだすとともに,抗腫瘍効果の応答性を確認することができる.我々はこれまでにおおむね基礎的検討を終了したために,現在,第I相試験のための非臨床試験に向けて,ハイブリッドペプチドの薬物動態および毒性の評価を行っている.ハイブリッドペプチドの投与方法や投与スケジュールに関しては,当研究室のこれまでの動物実験で見いだされた濃度をもとに,薬物動態試験を行った上でハイブリッドペプチドの血中濃度の推移を正確に評価し,検討する必要がある.現在,ラットを用いてペプチドの投与後に経時的に採血して得た検体を用いて,ハイブリッドペプチドの固相抽出を行い,LC/MS/MSを用いた質量分析法により血中濃度測定を行う系を確立した.今後は,この系を用いて,さらに詳細に血中濃度の測定を行う予定である.一方,ハイブリッドペプチドの有効用量をマウスに投与した際に,主要な臓器で顕著な毒性が認められないことをこれまでに確認しているが,より詳細な安全性についての知見を得るために,医薬品毒性試験法ガイドライン69)の単回投与毒性試験を参考に,ハイブリッドペプチドを1回投与した際の毒性を質的量的に明らかにすることが第一段階である.現在,正常のマウス,ラットを用いて,ハイブリッドペプチドを静脈内投与して毒性発現用量や毒性の種類についての評価を行っており,単回投与毒性試験の次に反復投与毒性試験を行う予定である(図7).また,我々は,ハイブリッドペプチドの経口製剤としての可能性も検討するために,現在,腸管吸収促進剤である胆汁酸を用いて,ハイブリッドペプチドと組み合わせることで,ペプチドの吸収性および薬効の向上,安全性の評価を行っている(図7).これら得られた結果をもとに,薬効と安全性を勘案して,ハイブリッドペプチドの投与量,投与方法および投与スケジュール,さらには,非臨床試験のステップへの検討を行う予定である.
世界的にみてがん治療薬全体の市場は毎年成長がみられており,その大半は分子標的薬の売上増加によるものである.その中で,近年では,モノクローナル抗体などの抗体医薬品が売り上げの上位を占める.しかしながら,生物学的に製造される抗体医薬品は製造コストが高騰し,このため薬剤価格が高額となり,費用対効果の観点から,たとえば2009年の英国国立医療技術評価機構の分子標的および抗体医薬に関して保健医療に推奨しないという勧告など70),将来的に医療経済的理由から使用が制限されることや,その結果,これら分子標的抗がん剤の恩恵を享受できない患者が増えることが予想される.既存の抗体医薬においてすでに認知された分子を標的とし,既存の抗体医薬とは異なる作用機序で薬剤耐性を有するがん細胞に対して抗がん活性を示し,全化学合成可能なため製造原価を抑え安価で提供できる可能性があるハイブリッドペプチドは,将来,経済的理由からその恩恵を享受できない患者に対して福音となることが期待される.臨床応用のためには,もちろん今後さらに数多くのステップおよび課題点を克服していく必要があるが,将来のハイブリッドペプチドを用いた新たながん分子標的療法を目指し,現在,さらなる研究を進めている.
謝辞Acknowledgments
本研究は,京都大学医学研究科薬剤疫学分野において,原本真里氏,大原弘路氏,川本恵氏,楊麗英氏,多田典子氏,菊池理氏の研究成果も含まれており,ここに感謝申し上げます.また,共同研究者である,京都大学 平岡眞寛教授,武藤学教授,田畑泰彦教授,原田浩教授,松崎勝巳教授,矢野義明講師,大橋真也助教に深謝いたします.
引用文献References
1) 厚生労働省「平成22年人口動態統計」.
2) Pastan, I. & FitzGerald, D. (1991) Science, 254, 1173–1177.
3) Kawakami, K., Nakajima, O., Morishita, R., & Nagai, R. (2006) Sci. World J., 6, 781–790.
4) Simon, N. & FitzGerald, D. (2016) Toxins (Basel), 8, E137.
5) Kawakami, K., Kawakami, M., Husain, S.R., & Puri, R.K. (2002) Cancer Res., 62, 3575–3580.
6) Ishige, K., Shoda, J., Kawamoto, T., Matsuda, S., Ueda, T., Hyodo, I., Ohkohchi, N., Puri, R.K., & Kawakami, K. (2008) Int. J. Cancer, 123, 2915–2922.
7) Kawakami, K., Kawakami, M., Joshi, B.H., & Puri, R.K. (2001) Cancer Res., 61, 6194–6200.
8) Kawakami, M., Kawakami, K., & Puri, R.K. (2002) Mol. Cancer Ther., 1, 999–1007.
9) Kunwar, S., Chang, S., Westphal, M., Vogelbaum, M., Sampson, J., Barnett, G., Shaffrey, M., Ram, Z., Piepmeier, J., Prados, M., Croteau, D., Pedain, C., Leland, P., Husain, S.R., Joshi, B.H., & Puri, R.K., & PRECISE Study Group. (2010) Neuro-oncol., 12, 871–881.
10) Huang, L. & Fu, L. (2015) Acta Pharm. Sin. B, 5, 390–401.
11) Karapetis, C.S., Khambata-Ford, S., Jonker, D.J., O’Callaghan, C.J., Tu, D., Tebbutt, N.C., Simes, R.J., Chalchal, H., Shapiro, J.D., Robitaille, S., Price, T.J., Shepherd, L., Au, H.J., Langer, C., Moore, M.J., & Zalcberg, J.R. (2008) N. Engl. J. Med., 359, 1757–1765.
12) Zasloff, M. (1987) Proc. Natl. Acad. Sci. USA, 84, 5449–5453.
13) Suarez-Carmona, M., Hubert, P., Delvenne, P., & Herfs, M. (2015) Cytokine Growth Factor Rev., 26, 361–370.
14) Münch, D. & Sahl, H.G. (2015) Biochim. Biophys. Acta, 1848(11 Pt B), 3062–3071.
15) Zasloff, M. (2002) Nature, 415, 389–395.
16) Papo, N. & Shai, Y. (2003) Biochemistry, 42, 9346–9354.
17) Papo, N., Shahar, M., Eisenbach, L., & Shai, Y. (2003) J. Biol. Chem., 278, 21018–21023.
18) Papo, N., Braunstein, A., Eshhar, Z., & Shai, Y. (2004) Cancer Res., 64, 5779–5786.
19) Nemudraya, A.A., Richter, V.A., & Kuligina, E.V. (2016) Acta Naturae, 8, 48–57.
20) Tan, Y., Tian, T., Liu, W., Zhu, Z., & Yang, C. J. (2016) Biotechnol. J., 11, 732–745.
21) Kohno, M., Horibe, T., Haramoto, M., Yano, Y., Nakajima, O., Matsuzaki, K., & Kawakami, K. (2011) Eur. J. Cancer, 47, 773–783.
22) Yewale, C., Baradia, D., Vhoral, I., Patil, S., & Misra, A. (2013) Biomaterials, 34, 8690–8707.
23) Woodburn, J.R. (1999) Pharmacol. Ther., 82, 241–250.
24) Yarden, Y. & Sliwkowski, M.X. (2001) Nat. Rev. Mol. Cell Biol., 2, 127–137.
25) Grunwald, V. & Hidalgo, M. (2003) J. Natl. Cancer Inst., 95, 851–867.
26) Janne, P.A., Engelman, J.A., & Johnson, B.E. (2005) J. Clin. Oncol., 23, 3227–3234.
27) Li, Z., Zhao, R., Wu, X., Sun, Y., Yao, M., Li, J., Xu, Y., & Gu, J. (2005) FASEB J., 19, 1978–1985.
28) Tada, N., Horibe, T., Haramoto, M., Ohara, K., Kohno, M., & Kawakami, K. (2011) Biochem. Biophys. Res. Commun., 407, 383–388.
29) Tortorella, S. & Karagiannis, T.C. (2014) J. Membr. Biol., 247, 291–307.
30) Ponka, P. & Lok, C.N. (1999) Int. J. Biochem. Cell Biol., 31, 1111–1137.
31) Habeshaw, J.A., Lister, T.A., Stansfeld, A.G., & Greaves, M.F. (1983) Lancet, 1, 498–501.
32) Kondo, K., Noguchi, M., Mukai, Z., Matsuno, Y., Sato, Y., Shimosato, Y., & Monden, Y. (1990) Chest, 97, 1367–1371.
33) Lee, J.H., Engler, J.A., Collawn, J.F., & Moore, B.A. (2001) Eur. J. Biochem., 268, 2004–2012.
34) Kawamoto, M., Horibe, T., Kohno, M., & Kawakami, K. (2011) BMC Cancer, 11, 359.
35) Recondo, G. Jr., de la Vega, M., Galanternik, F., Díaz-Cantón, E., Leone, B.A., & Leone, J.P. (2016) Cancer Manag. Res., 8, 57–65.
36) Graus-Porta, D., Beerli, R.R., Daly, J.M., & Hynes, N.E. (1997) EMBO J., 16, 1647–1655.
37) Rubin, I. & Yarden, Y. (2001) Ann. Oncol., 12(Suppl 1), S3–S8.
38) Stern, D.F. (2000) Breast Cancer Res., 2, 176–183.
39) Karasseve, N.G., Glinsky, V.V., Chen, N.X., Komatireddy, R., & Quinn, T.P. (2002) J. Protein Chem., 21, 287–296.
40) Kawamoto, M., Horibe, T., Kohno, M., & Kawakami, K. (2013) Mol. Cancer Ther., 12, 384–393.
41) Idzerda, R.L., March, C.J., Mosley, B., Lyman, S.D., Vanden Bos, T., Gimpel, S.D., Din, W.S., Grabstein, K.H., Widmer, M.B., Park, L.S., Cosman, D., & Beckman, M.P. (1990) J. Exp. Med., 171, 861–873.
42) Kawakami, M., Kawakami, K., & Puri, R.K. (2003) J. Neurooncol., 65, 15–25.
43) Murata, T., Taguchi, J., & Puri, R.K. (1998) Blood, 91, 3884–3891.
44) Yang, R., Horibe, T., Kohno, M., Haramoto, M., Ohara, K., Puri, R., & Kawakami, K. (2012) Mol. Cancer Ther., 11, 235–243.
45) Debinski, W., Gibo, D.M., Hulet, S.W., Connor, J.R., & Gillespie, G.Y. (1999) Clin. Cancer Res., 5, 985–990.
46) Thaci, B., Brown, C.E., Binello, E., Werbaneth, K., Sampath, P., & Sengupta, S. (2014) Neuro-oncol., 16, 1304–1312.
47) Kawamoto, M., Kohno, M., Horibe, T., & Kawakami, K. (2013) Cancer Chemother. Pharmacol., 71, 799–807.
48) Tanaka, G., Nakase, I., Fukuda, Y., Masuda, R., Oishi, S., Shimura, K., Kawaguchi, Y., Takatani-Nakase, T., Langel, U., Gräslund, A., Okawa, K., Matsuoka, M., Fujii, N., Hatanaka, Y., & Futaki, S. (2012) Chem. Biol., 19, 1437–1446.
49) Zhou, J., Liu, W., Pong, R.C., Hao, G., Sun, X., & Hsieh, J.T. (2012) Amino Acids, 42, 1253–1260.
50) Takuma, K., Fang, F., Zhang, W., Yan, S., Fukuzaki, E., Du, H., Sosunov, A., McKhann, G., Funatsu, Y., Nakamichi, N., Nagai, T., Mizoguchi, H., Ibi, D., Hori, O., Ogawa, S., Stern, D.M., Yamada, K., & Yan, S.S. (2009) Proc. Natl. Acad. Sci. USA, 106, 20021–20026.
51) Deane, R., Wu, Z., Sagare, A., Davis, J., Du Yan, S., Hamm, K., Xu, F., Parisi, M., LaRue, B., Hu, H.W., Spijkers, P., Guo, H., Song, X., Lenting, P.J., Van Nostrand, W.E., & Zlokovic, B.V. (2004) Neuron, 43, 333–344.
52) Ohara, K., Kohno, M., Hamada, T., & Kawakami, K. (2013) Peptides, 50, 28–35.
53) Kohno, M., Horibe, T., Ohara, K., Ito, S., & Kawakami, K. (2014) Chem. Biol., 21, 1522–1532.
54) Kuroda, J., Kuratsu, J., Yasunaga, M., Koga, Y., Saito, Y., & Matsumura, Y. (2009) Int. J. Cancer, 124, 2505–2511.
55) Plummer, R., Wilson, R.H., Calvert, H., Boddy, A.V., Griffin, M., Sludden, J., Tilby, M.J., Eatock, M., Pearson, D.G., Ottley, C.J., Matsumura, Y., Kataoka, K., & Nishiya, T. (2011) Br. J. Cancer, 104, 593–598.
56) Kato, K., Chin, K., Yoshikawa, T., Yamaguchi, K., Tsuji, Y., Esaki, T., Sakai, K., Kimura, M., Hamaguchi, T., Shimada, Y., Matsumura, Y., & Ikeda, R. (2012) Invest. New Drugs, 30, 1621–1627.
57) Ikada, Y. & Tabata, Y. (1998) Adv. Drug Deliv. Rev., 31, 287–301.
58) Gaowa, A., Horibe, T., Kohno, M., Sato, K., Harada, H., Hiraoka, M., Tabata, Y., & Kawakami, K. (2014) J. Control. Release, 176, 1–7.
59) Russo, A., DeGraff, W., Friedman, N., & Mitchell, J.B. (1986) Cancer Res., 46, 2845–2848.
60) Thambi, T., Yoon, H.Y., Kim, K., Kwon, I.C., Yoo, C.K., & Park, J.H. (2011) Bioconjug. Chem., 22, 1924–1931.
61) Khorsand, B., Lapointe, G., Brett, C., & Oh, J.K. (2013) Biomacromolecules, 14, 2103–2111.
62) Gaowa, A., Horibe, T., Kohno, M., Harada, H., Hiraoka, M., Tabata, Y., & Kawakami, K. (2015) Eur. J. Pharm. Biopharm., 92, 228–236.
63) Patanaphan, V. & Salazar, O.M. (1993) South. Med. J., 86, 38–41.
64) Gaowa, A., Horibe, T., Kohno, M., Harada, H., Hiraoka, M., & Kawakami, K. (2015) Clin. Exp. Metastasis, 33, 87–95.
65) Kikuchi, O., Ohashi, S., Horibe, T., Kohno, M., Nakai, Y., Miyamoto, S., Chiba, T., Muto, M., & Kawakami, K. (2016) Sci. Rep., 6, 22452.
66) Laskin, J.J. & Sandler, A.B. (2004) Cancer Treat. Rev., 30, 1–17.
67) Ozawa, S., Ueda, M., Ando, N., Shimizu, N., & Abe, O. (1989) Cancer, 63, 2169–2173.
68) Limentani, S.A., Campone, M., Dorval, T., Curigliano, G., de Boer, R., Vogel, C., White, S., Bachelot, T., Canon, J.L., Disis, M., Awada, A., Berlière, M., Amant, F., Levine, E., Burny, W., Callegaro, A., de Sousa Alves, P.M., Louahed, J., Brichard, V., & Lehmann, F.F. (2016) Breast Cancer Res. Treat., 156, 319–330.
69) 医薬品毒性試験法ガイドライン(平成元年9月11日薬審1第24号)のうち一部改正(平成5年8月10日薬新薬第8号).
70) https://www.nice.org.uk/guidance/TA178
著者紹介Author Profile
 堀部 智久(ほりべ ともひさ)
堀部 智久(ほりべ ともひさ)京都大学大学院医学研究科薬剤疫学分野特定講師.博士(理学).
略歴1974年京都府に生る.98年立命館大 理工学部化学科卒業.2003年同大学院博士課程修了後,同大学,その後豪州において博士研究員.07年ヒューマンサイエンス振興財団リサーチレジデント後,08年京都大学大学院医学研究科薬剤疫学分野特定助教を経て,13年より現職.
研究テーマと抱負現在,分子シャペロンのがん細胞における機能的役割および生物発光を用いた新たな実験手法(一細胞レベル発光イメージング)に関する研究も行っており,これらの取り組みおよび研究成果が新たながん治療につながればと思います.
趣味つり,阪神戦観戦,最近は子供とクワガタ飼育すること.