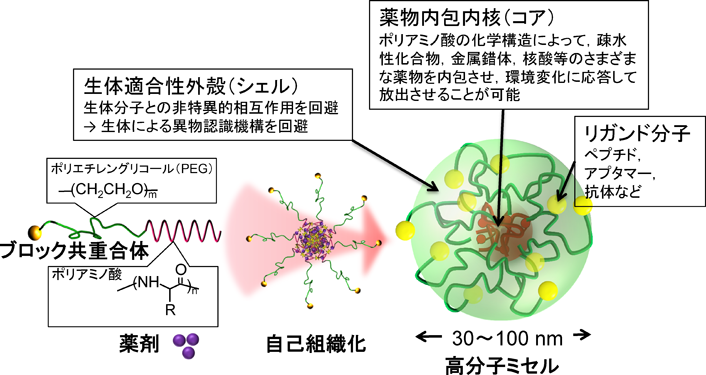
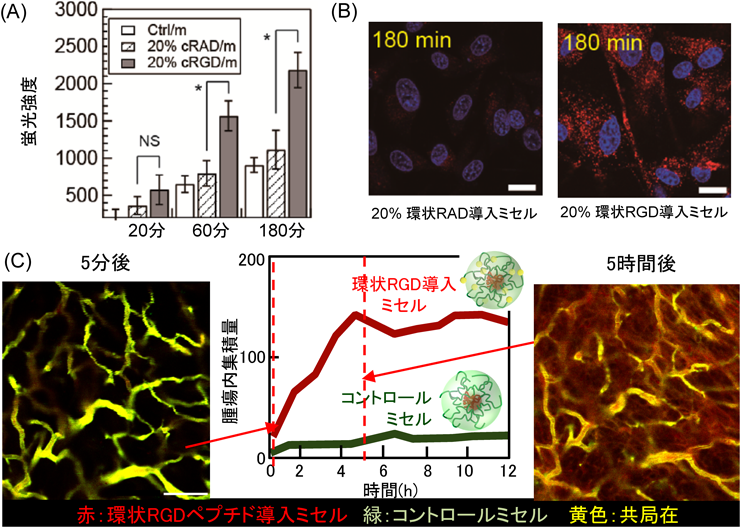
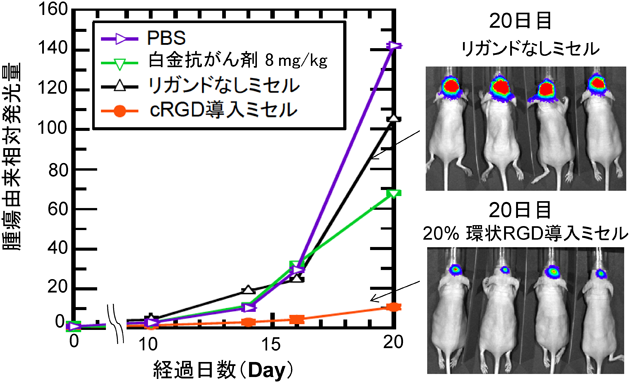
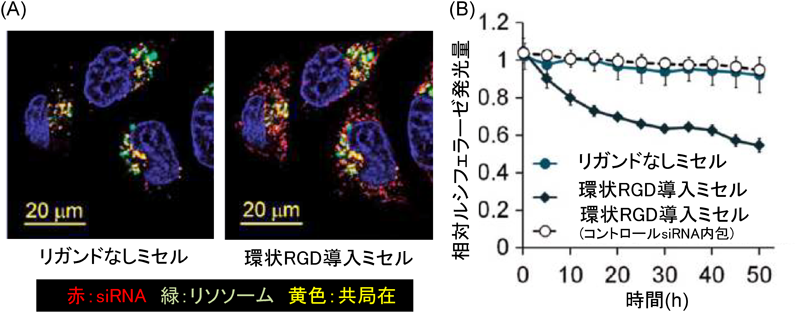
1) Matsumura, Y. & Maeda, H. (1986) Cancer Res., 46, 6387–6392.
5) Tucker, G.C. (2003) Curr. Opin. Investig. Drugs, 4, 722–731.
6) Stupp, R., Mason, W.P., van den Bent, M.J., Weller, M., Fisher, B., Taphoorn, M.J., Belanger, K., Brandes, A.A., Marosi, C., Bogdahn, U., Curschmann, J., Janzer, R.C., Ludwin, S.K., Gorlia, T., Allgeier, A., Lacombe, D., Cairncross, J.G., Eisenhauer, E., & Mirimanoff, R.O.; European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group. (2005) N. Engl. J. Med., 352, 987–996.
8) Miura, Y., Takenaka, T., Toh, K., Wu, S., Nishihara, H., Kano, M.R., Ino, Y., Nomoto, T., Matsumoto, Y., Koyama, H., Cabral, H., Nishiyama, N., & Kataoka, K. (2013) ACS Nano, 7, 8583–8592.
9) Zhan, C., Gu, B., Xie, C., Li, J., Liu, Y., & Lu, W. (2010) J. Control. Release, 143, 136–142.
12) Khalil, I.A., Kogure, K., Futaki, S., & Harashima, H. (2006) J. Biol. Chem., 281, 3544–3511.
13) Kim, H.-J., Takemoto, H., Yi, Y., Zheng, M., Maeda, Y., Chaya, H., Hayashi, K., Mi, P., Pittella, F., Christie, R.J., Toh, K., Matsumoto, Y., Nishiyama, N., Miyata, K., & Kataoka, K. (2014) ACS Nano, 8, 8979–8991.
14) Hurt, E.M., Chan, K., Serrat, M.A.D., Thomas, S.B., Veenstra, T.D., & Farrar, W.L. (2010) Stem Cells, 28, 390–398.