3) Yamaoka, S., Miyaji, M., Kitano, T., Umehara, H., & Okazaki, T. (2004) J. Biol. Chem., 279, 18688–18693.
4) Hirabayashi, Y., Igarashi, Y., & Merrill, A.H. (Eds.) (2006) Sphingolipid Biology, Springer, Tokyo.
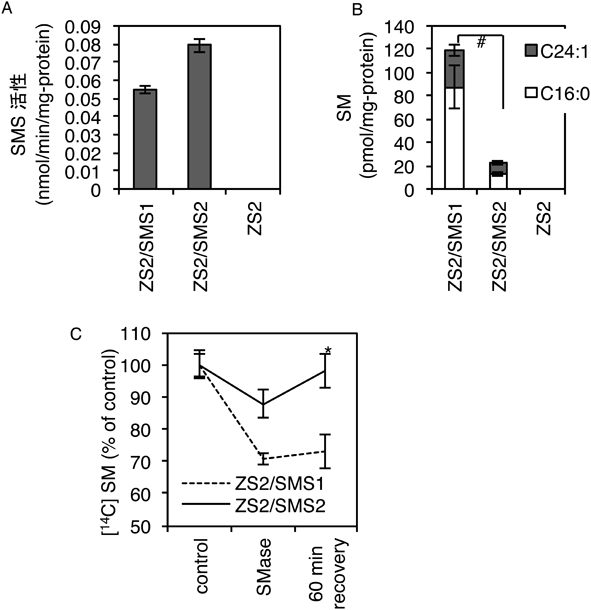
5) Mitsutake, S., Zama, K., Yokota, H., Yoshida, T., Tanaka, M., Mitsui, M., Ikawa, M., Okabe, M., Tanaka, Y., Yamashita, T., Takemoto, H., Okazaki, T., Watanabe, K., & Igarashi, Y. (2011) J. Biol. Chem., 286, 28544–28555.
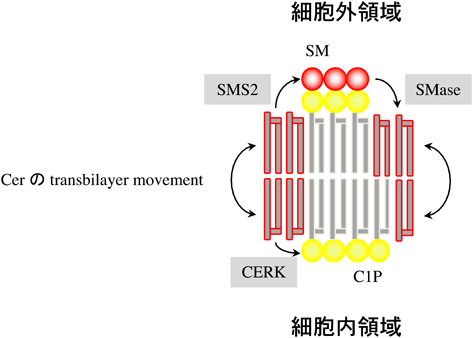
7) Mitsutake, S., Kim, T.J., Inagaki, Y., Kato, M., Yamashita, T., & Igarashi, Y. (2004) J. Biol. Chem., 279, 17570–17577.
10) Yano, M., Watanabe, K., Yamamoto, T., Ikeda, K., Senokuchi, T., Lu, M., Kadomatsu, T., Tsukano, H., Ikawa, M., Okabe, M., Yamaoka, S., Okazaki, T., Umehara, H., Gotoh, T., Song, W.J., Node, K., Taguchi, R., Yamagata, K., & Oike, Y. (2011) J. Biol. Chem., 286, 3992–4002.
11) Nagy, L., Tontonoz, P., Alvarez, J.G., Chen, H., & Evans, R.M. (1998) Cell, 93, 229–240.
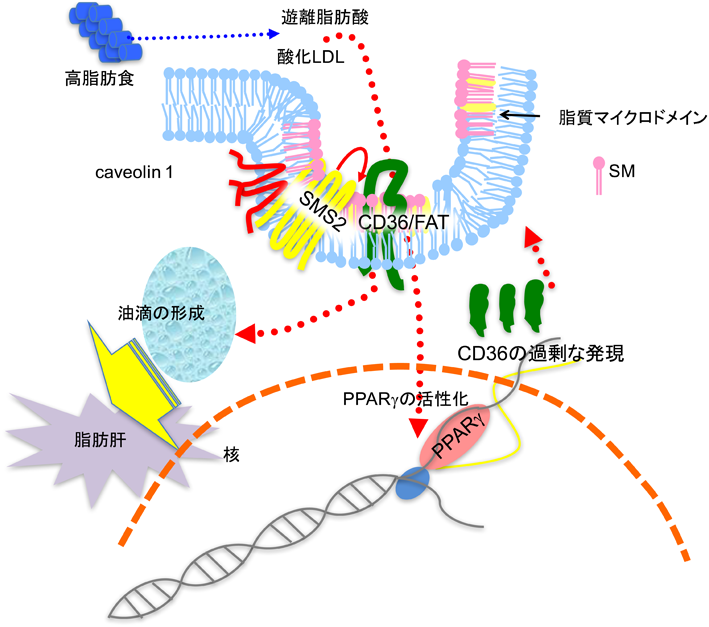
12) Mitsutake, S., Date, T., Yokota, H., Sugiura, M., Kohama, T., & Igarashi, Y. (2012) FEBS Lett., 586, 1300–1305.