接触阻害とは,増殖しながら運動している二つの近接した培養細胞間で観察される現象である.1953年,AbercrombieとHeaysmanは,運動しているニワトリ心臓胚性線維芽細胞が近接した細胞と接触すると,運動先導端に形成された細胞膜突出部が退縮して運動を停止した後,接触するまでとは異なる方向に運動し始めることを報告した1).以後,同様に,上皮細胞や神経堤細胞,血球細胞も接触すると運動を停止することが報告され,接触阻害と呼ばれてきた.一方,細胞が増殖してコンフルエントな単層シートを形成するようになると増殖を停止することも接触阻害と呼ばれるようになった.この二つの現象は,現在ではそれぞれ,細胞運動の接触阻害,細胞増殖の接触阻害と呼ばれている2, 3).細胞の運動と増殖の接触阻害は胚発生や成体における再生時の適切な形態形成と組織構造の維持に必須であり2, 3),接触阻害の破綻は腫瘍形成に関与していると考えられている.接触阻害の分子機構の解明のためには,細胞間接着,細胞運動,細胞増殖,およびこれら三つの細胞応答間の相互作用の分子機構の解明が必要である.約30年前までは,知られていた細胞間接着分子はカドヘリンのみであり,増殖因子受容体およびインテグリンがそれぞれ低分子量Gタンパク質であるRasおよびRhoといった細胞内シグナルを活性化して細胞の増殖と運動に関与することが示されていただけであった.その後,Eph–Ephrin系やWnt/PCP経路,Hippo経路といった新しいシグナル伝達経路が発見され,接触阻害の分子機構の解明は進んだ.本稿では,こうした新しいシグナル伝達経路を介する接触阻害機構について概説するとともに,筆者らが最近明らかにしたNecl-4を介した新たな接触阻害機構について紹介する.
1)Eph–Ephrin系を介した細胞運動の接触阻害機構
Eph–Ephrinの相互作用は,受容体(Eph)とリガンド(Ephrin)を発現する細胞間で接触型の双方向性のシグナル伝達を惹起する.隣接する前立腺がん細胞間では,Ephrinとのトランス相互作用によるEphA受容体の活性化によって細胞は運動を停止して,後退する4).EphA受容体が活性化されると,細胞内でRhoAが活性化される結果,アクトミオシンが収縮し,細胞は後退する.微小管を安定化させ脱重合を阻害するtaxolで細胞を処理すると,細胞運動の接触阻害は阻害されることから,微小管の脱重合も必要である.このようにEph–Ephrin系は,特に接触後の運動方向の変換に重要な役割を果たしている.
2)Wnt/PCP経路を介した細胞運動の接触阻害機構
Carmona-Fontaineらはアフリカツメガエルやゼブラフィッシュの神経堤細胞を用いて,平面内細胞極性に関与するWnt/PCP経路を介したin vivoにおける細胞運動の接触阻害機構を報告した5).FrizzledやDishevelledなどのPCP(planar cell polarity)分子が細胞接着面にリクルートされてRhoが活性化される結果,細胞膜突出部が崩壊し,細胞極性が変化する.
細胞運動の接触阻害では,近接した細胞と接触すると,細胞により異なる機構を介して運動先導端でRacに代わってRhoが活性化されて細胞膜突出部が退縮し,アクチンや微小管により生じる張力,細胞極性が変化し,非接触部に新たに細胞膜突出部が形成されて,その方向に運動し始めると考えられている6).このようにWnt/PCP経路は,特に接触後の運動方向変換時の極性変化に重要な役割を果たしている.
3)Hippo経路を介した細胞増殖の接触阻害機構
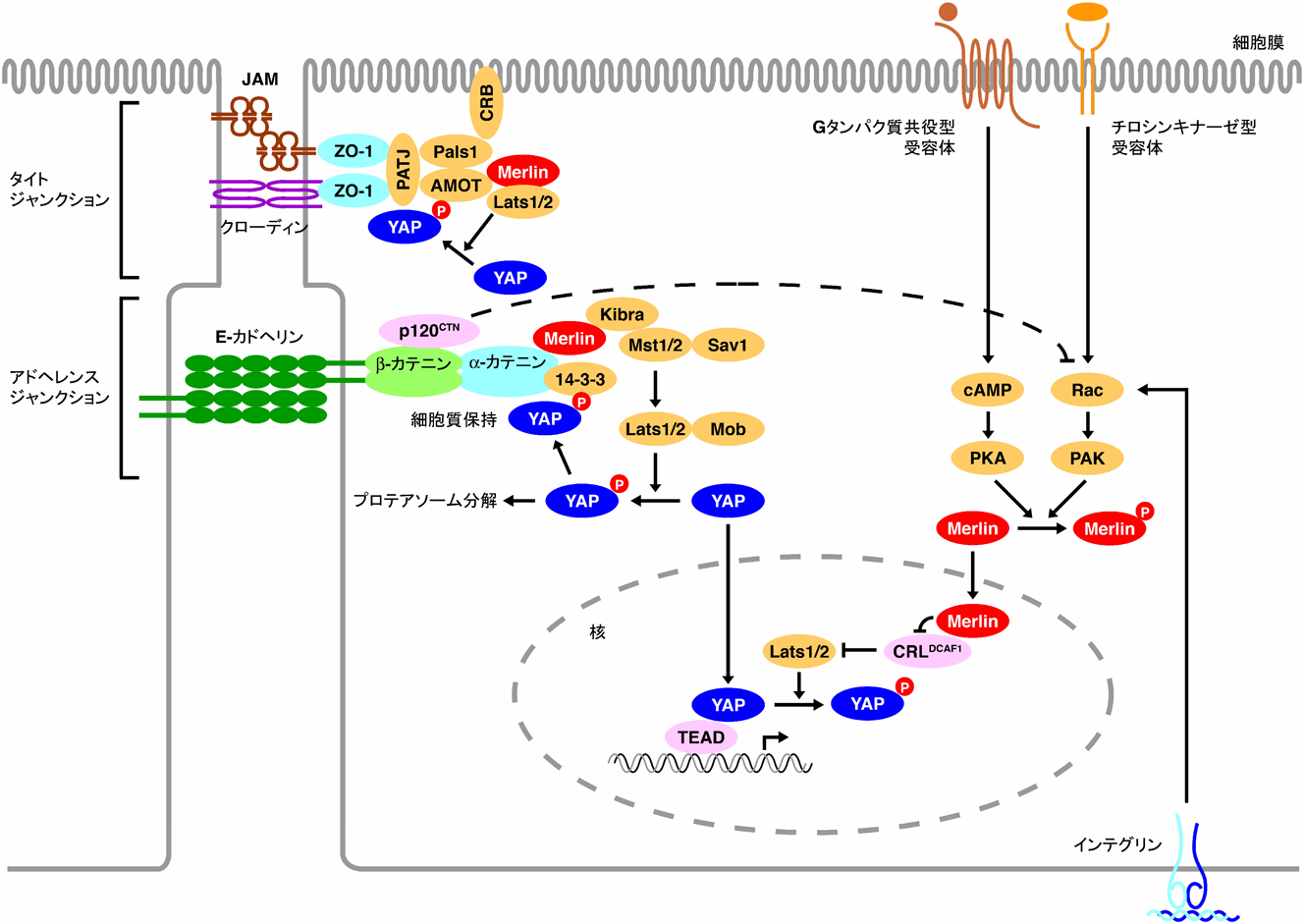
Hippo経路は進化的に保存された細胞密度応答性シグナル伝達経路であり,個体における器官のサイズ決定に関与している7).哺乳動物においては,Hippo経路は主に,ショウジョウバエのHippoのホモログであるMst1/2(mammalian ste20-like kinase 1/2),Sav1(salvador 1),Mob(mps one binder),Lats1/2(large tumor suppressor 1/2),YAP(Yes-associated protein),TAZ(transcriptional coactivator with PDZ-binding motif),TEADにより構成されている.近接する細胞が接触するなどして外部から物理的刺激が加わると,Mst1/2が活性化されてMobをリン酸化する.リン酸化されたMobはLats1/2に作用し,Mst1/2によるLats1/2のリン酸化を促進する.リン酸化され活性化されたLats1/2は転写共役因子であるYAPとTAZをリン酸化する.YAPとTAZは,通常は核内に局在して細胞増殖を促進しているが,リン酸化されると核内から細胞質へと移動し,転写共役因子として機能しなくなることや細胞質において分解されることによって,細胞増殖促進作用を失う.Lats1/2はYAPの五つのセリン残基をリン酸化するが,このうち127番目のセリン残基がリン酸化されると,14-3-3タンパク質がこのセリン残基に直接結合してYAPを細胞質に保持する.一方で,397番目のセリン残基がリン酸化されると,YAPとユビキチンリガーゼ複合体との相互作用が生じ,ユビキチン・プロテアソーム系によって分解される.核内に局在するYAPは転写因子TEADを介して細胞増殖の促進や細胞死の抑制に関与する遺伝子群の発現を促進している.このように,Hippo経路はLats1/2によるリン酸化を介してYAPとTAZの細胞内局在と安定性を制御することで転写を調節し,細胞増殖を抑制している8)(図1).
Hippo経路が作動する分子機構にはまだ不明な点が多いが,隣接する細胞や細胞外基質との接触状態の違いによって巧妙に制御されていることが明らかになりつつある9).細胞間に形成される密着結合,接着結合,頂端極性複合体の構成因子はHippo経路の上流制御因子として機能している(図1).たとえば,近接する二つの細胞が接着すると,カドヘリンはカテニンを介してがん抑制遺伝子NF2の産物であるMerlinを制御して,Mst1/2の活性化を制御している8, 10–12).さらに,細胞外基質との接触による外的な物理的圧力は,アクチン細胞内骨格系を介してHippo経路の活性化を調節し,YAPおよびTAZを介して核内での遺伝子発現誘導に至ることも明らかになっている.
このように,接触後のEph–Ephrin系やWnt/PCP経路を介した細胞運動方向の変換機構や,ジャンクション形成後のHippo経路を介した細胞増殖阻害機構は明らかになったものの,これらの分子だけでは,接触阻害の開始段階で運動や増殖が減速し始める機構を完全には説明できていなかった.
3. ネクチンとNeclを介した細胞の運動と増殖の接触阻害機構
1)Necl-5を介した接触阻害機構
免疫グロブリン様細胞接着分子のネクチンは,ネクチン-1からネクチン-4の四つのメンバーからなるファミリーを構成し,細胞間接着,細胞の運動と増殖を調節している13, 14).たとえば,上皮細胞では,ネクチンのトランス相互作用によって,まず初期の細胞間接着が誘導され,次にネクチンどうしの結合による接着部位にカドヘリンがリクルートされて,最終的にアドヘレンスジャンクション(AJ)が形成される13, 14).AJの形成中もしくは形成後に,ネクチンはカドヘリンと協調してAJの頭頂側へ,まずオクルディンとクローディンを,次にJAMをリクルートしてタイトジャンクションを形成する.このように細胞間接着は段階的に形成される.
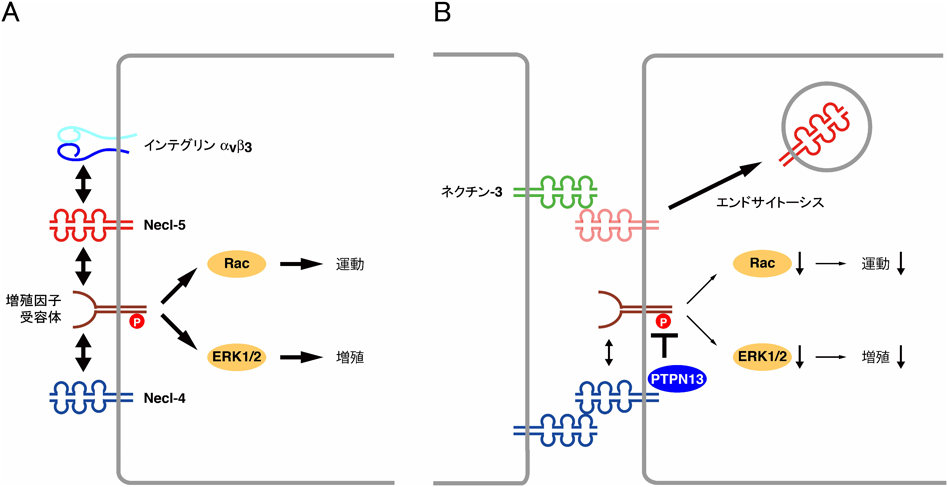
増殖因子受容体,インテグリンに次いで細胞の運動と増殖を調節する第三の因子がネクチン様分子-5(Necl-5)である.Neclは,Necl-1からNecl-5の五つのメンバーからなるファミリーを形成する13, 14).血小板由来増殖因子(PDGF)に応答して運動しているマウスNIH3T3線維芽細胞では,Necl-5はPDGF受容体およびインテグリンαVβ3と複合体を形成し,運動先導端に局在する13, 14).この複合体は,Rap, RacおよびRhoの周期的な活性化と不活性化を調節して,細胞運動に必要なラメリポディア,ラッフル,フォーカルコンプレックスといった運動先導端構造の形成を誘導する.さらに,この複合体はRas-ERK経路の負の調節因子であるsprouty-2を阻害して細胞増殖を促進する.このように,Necl-5はNIH3T3細胞の運動と増殖を促進しているが,二つのNIH3T3細胞が衝突してNecl-5が隣接する細胞の表面上のネクチン-3とトランス相互作用すると,Necl-5はエンドサイトーシスによって細胞表面からダウンレギュレーションされ(これによりNecl-5による運動と増殖の促進作用がなくなり),代わってネクチン-1がネクチン-3とトランス相互作用することによって細胞間接着の形成が開始される.ネクチンどうしの結合後,結合部位にリクルートされたカドヘリンどうしの結合によりAJが形成されて細胞運動が阻害されるとともに,Hippo経路が活性化されて細胞増殖が阻害される.このようにネクチンとNecl-5は,協働して細胞間接着,細胞の運動と増殖を調節し,カドヘリンが関与する段階よりも早期の細胞の運動と増殖の接触阻害の開始段階で重要な役割を果たしている(図2)13, 14).
2)Necl-4を介した新たな接触阻害機構
接触阻害は少なくとも,細胞の運動と増殖が減少する開始段階と細胞間接着が安定的に確立された維持段階の二つの段階からなると考えられる.筆者らは,最近,培養ヒト臍帯静脈内皮細胞(HUVEC)を用いて,Necl-4が接触阻害の開始段階における新規調節因子として機能していることを見いだした15).これまでに,Necl-4は非受容体型チロシンホスファターゼのPTPN13を介してヘレグリンによるErbB2/ErbB3の活性化を阻害すること,ホルボールエステルによるヘミデスモソームの崩壊を抑制すること,がん抑制因子として作用していることが報告されている.
血管内皮増殖因子(VEGF)は主に血管内皮増殖因子受容体(VEGFR2)をリン酸化,活性化して細胞内にシグナルを伝達し,HUVECなどの血管内皮細胞の運動や増殖を促進する.Necl-4は細胞外領域を介してVEGFR2と結合しており,HUVECが増殖して細胞密度が増加しNecl-4どうしが相互作用するとNecl-4の発現は増加する.Necl-4は,PTPN13を介してVEGFによるVEGFR2の1175番目のチロシン残基のリン酸化を抑制することによって,VEGFR2の下流の細胞内シグナルであるRacとERK1/2の活性化を抑制する結果,細胞の運動と増殖が低下する.このようにNecl-4は,細胞密度が増加して細胞どうしが接触するとVEGFR2シグナルの活性化を抑制し,血管内皮細胞の運動と増殖を阻害する(図2).
Necl-4の発現は細胞密度依存性に増加するが,これには少なくとも転写レベルでの調節が関与している.
ところで,奇異ではあるが,細胞密度が疎で,増殖しながら運動しているHUVECにおいては,Necl-4は細胞の運動と増殖を促進している.Necl-4による細胞運動の促進には,PTPN13とROCK(Rho-associated kinase)が関与している.すなわち,Necl-4はPTPN13によるROCKの活性化を抑制することによって,VEGFによるRacの活性化を促進する結果,細胞の運動を促進する.一方,Necl-4による細胞増殖の促進には,PTPN13とROCKは関与しておらず,詳細な分子機構について現在解析中である.
本稿で紹介したNecl-4やNecl-5を介した接触阻害機構の生体内における作用についてはまだ不明な点が多い.Necl-4ノックアウトマウスやNecl-5ノックアウトマウスはともに,E-カドヘリンやVE-カドヘリンのノックアウトマウスとは異なり,発生に異常を認めない.したがって,少なくとも個体発生時にはNecl-4やNecl-5の欠損は他の機構によって代償されていると考えられる.