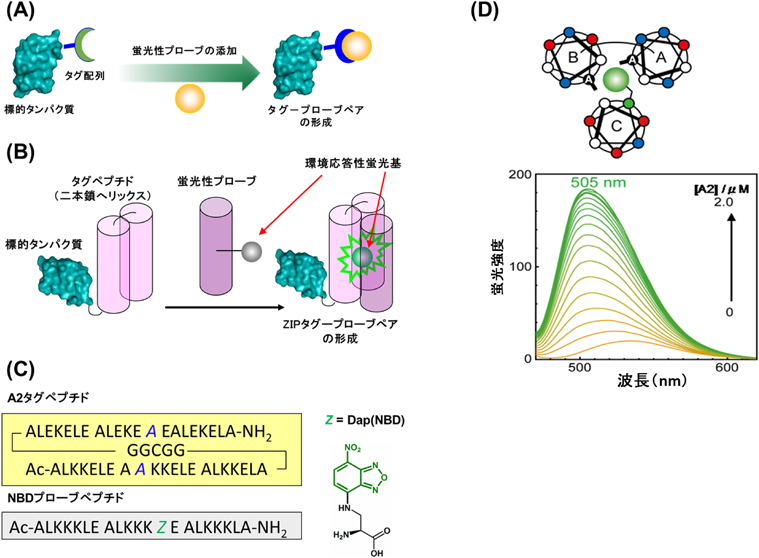
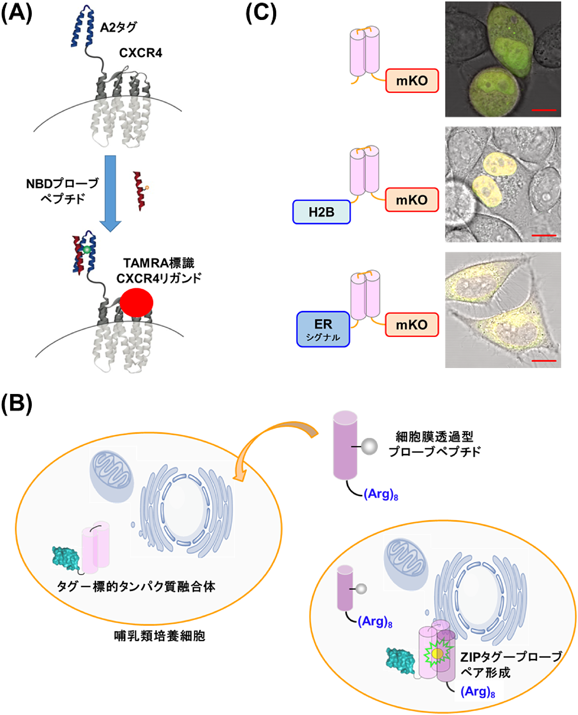
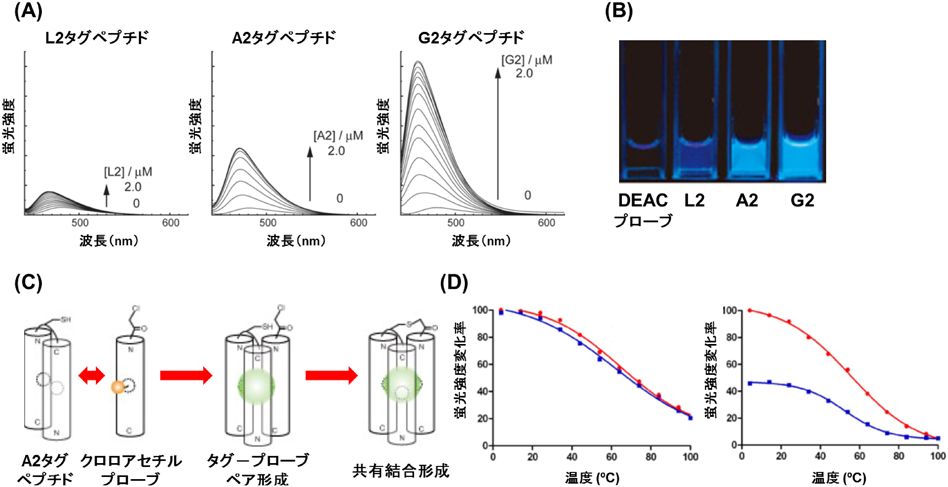
細胞内タンパク質を可視化するタグ–蛍光プローブシステムZIP tag-probe system: A fluorescence imaging tool for intercellular proteins
東京医科歯科大学生体材料工学研究所Institute of Biomaterials and Bioengineering, Tokyo Medical and Dental University ◇ 〒101–0062 東京都千代田区神田駿河台2–3–10 ◇ 2–3–10 Kandasurugadai, Chiyoda-ku, Tokyo 101–0062, Japan