1) Sampaio, J.L., Gerl, M.J., Klose, C., Ejsing, C.S., Beug, H., Simons, K., & Shevchenko, A. (2011) Proc. Natl. Acad. Sci. USA, 108, 1903–1907.
2) Fleming, F.E., Bohm, R., Dang, V.T., Holloway, G., Haselhorst, T., Madge, P.D., Deveryshetty, J., Yu, X., Blanchrd, H., von Itzstein, M., & Coulson, B.S. (2014) J. Virol., 88, 4558–4571.
3) Coskun, U., Grzybek, M., Drechsel, D., & Simons, K. (2011) Proc. Natl. Acad. Sci. USA, 108, 9044–9048.
6) Eggeling, C., Ringemann, C., Medda, R., Schwarzmann, G., Sandhoff, K., Polyankva, S., Belov, V.N., Hein, B., von Moddemdorf, C., Schönle, A., & Hell, S.W. (2009) Nature, 457, 1159–1162.
7) Chinnapen, D.J., Hsieh, W.T., te Weischer, Y.M., Saslowsky, D.E., Kaoutzani, L., Brandsma, E., D’Auria, L., Park, H., Wagmer, J.S., Drake, K.R., Kang, M., Benjamin, T., Ullman, M.D., Costello, C.E., Kenworthy, A.K., Baumgart, T., Massoi, R.H., & Lencer, W.I. (2012) Dev. Cell, 23, 573–586.
8) Hammond, A.T., Heberte, F.A., Baumgart, T., Holowka, D., Baird, D., & Geigenson, G.W. (2005) Proc. Natl. Acad. Sci. USA, 102, 6320–6325.
9) Tanaka, K.A.K., Suzuki, K.G.N., Shirai, Y.M., Shibutani, S.T., Miyahara, M.S., Tsuboi, H., Yahara, M., Yoshimura, A., Mayor, S., Fujiwara, T.K., & Kusumi, A. (2010) Nat. Methods, 7, 865–866.
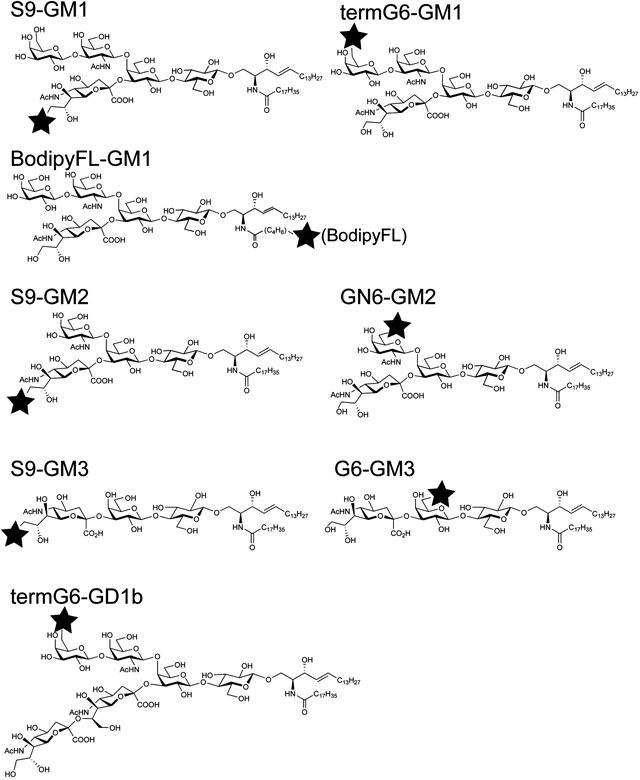
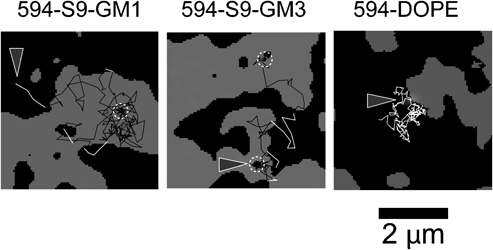
10) Komura, N., Suzuki, K.G.N., Ando, H., Konishi, M., Koikeda, M., Imamura, A., Chadda, R., Fujiwara, T.K., Tsuboi, H., Sheng, R., Cho, W., Furukawa, K., Furukawa, K., Yamauchi, Y., Ishida, H., Kusumi, A., & Kiso, M. (2016) Nat. Chem. Biol., 12, 402–410.
11) Suzuki, K.G.N., Kasai, R.S., Hirosawa, K.M., Nemoto, Y.L., Ishibashi, M., Miwa, Y., Fujiwara, T.K., & Kusumi, A. (2012) Nat. Chem. Biol., 8, 774–783.
12) Suzuki, K.G.N., Fujiwara, T.K., Sanematsu, F., Iino, R., Edidin, M., & Kusumi, A. (2007) J. Cell Biol., 177, 717–730.
13) Suzuki, K.G.N., Fujiwara, T.K., Edidin, M., & Kusumi, A. (2007) J. Cell Biol., 177, 731–742.
14) Sahl, S.J., Leutenegger, M., Hilbert, M., Hell, S.W., & Eggeling, C. (2010) Proc. Natl. Acad. Sci. USA, 107, 6829–6834.
15) Sezgin, E., Levental, I., Brzybek, M., Schwarzmann, G., Mueller, V., Honigmann, A., Belov, V.N., Eggeling, C., Coskun, U., Simons, K., & Schwille, P. (2012) Biochim. Biophys. Acta, 1818, 1777–1784.