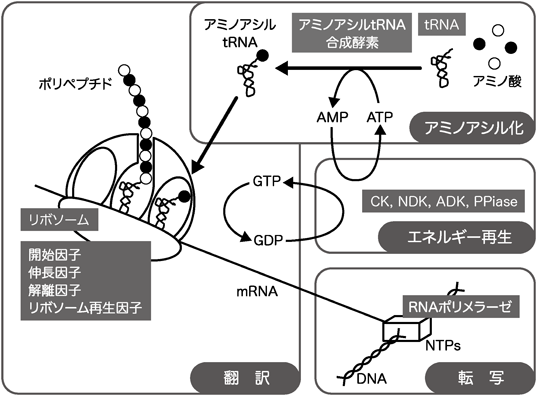
1)無細胞タンパク質合成系を用いたタンパク質の立体構造形成の解析
無細胞タンパク質合成系はタンパク質を合成するシステムであるが,細胞質で機能するポリペプチドはリボソーム上でアミノ酸が重合した後に構造形成をする必要がある.細胞内でのフォールディングプロセスには分子シャペロンが関与することが多いと考えられている.細胞抽出液を用いた無細胞タンパク質合成系では,内在性のシャペロンがフォールディングを促進することにより,合成産物が生理活性を有するような構造へと変換することが期待できる.また内在性のシャペロンでは不十分と予想される場合は,外部から添加する試みもなされている.それに対して,再構成型であるPURE systemでは,分子シャペロンを含まないため構造形成が不十分になる可能性がある.これは機能タンパク質の合成という点では欠点ではあるが,逆に各種シャペロンを加えることで,各々のタンパク質の構造形成に関与するシャペロンを同定することが可能である.一例として,PURE systemで大腸菌の全タンパク質を合成し,遠心により沈殿する,すなわち凝集するタンパク質を解析したところ,細胞質タンパク質の約半数が凝集すること,つまり約半数の大腸菌の細胞質タンパク質のフォールディングにシャペロンが必要であることが示された9).さらにこうしたシャペロンを必要とするタンパク質について,大腸菌の主要なシャペロンであるGroEL/ES, DnaK/J/GrpE, Trigger factorを加えて凝集抑制効果を測定している10).これら大腸菌の全タンパク質についての凝集特性とシャペロン依存性はeSOLという形でデータベース化され公表されている(http://www.tanpaku.org/tp-esol/).
2)無細胞タンパク質合成系を利用した膜タンパク質の合成
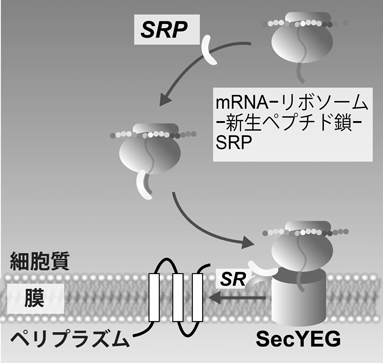
膜タンパク質は細胞質膜などの脂質膜上に局在するタンパク質であり,したがってその活動場所も脂質膜上である.膜タンパク質は大きく膜表在型,アンカリング型,膜挿入型に分類することができる.膜表在型はリン脂質からなる膜表面上に付着するタンパク質であり,明確な膜貫通領域を持たない.これに対しアンカリング型,挿入型は少なくとも一つ以上の膜貫通領域を持ち,それらは厚さ5 nmほどのリン脂質膜を貫通する.膜貫通領域は,約20アミノ酸残基ほどの疎水的なαヘリックス構造からなるのが一般的である.このような疎水的なペプチド鎖は細胞質中で凝集体を形成してしまうため,翻訳と同時に新生ペプチド鎖を脂質膜に挿入する必要がある.細胞内における翻訳と共役した膜挿入について,たとえば大腸菌ではまず翻訳段階初期の新生ペプチド鎖のN末端にある疎水的領域にsignal recognition particle(SRP)が結合し,mRNA–リボソーム–新生ペプチド鎖–SRPという複合体が形成される.これが膜表在タンパク質であるSRP receptor(SR)を介して脂質膜上に誘導され,膜内在性因子であるSecトランスロコンに結合した状態で膜タンパク質が合成されるというきわめて合理的な仕組みとなっている(図2).ちなみに,大腸菌型SRPはサブユニットタンパク質であるFfhと4.5S RNAから構成されており,この複合体がリボソームのExit tunnel上で合成途中の疎水的な新生ペプチド鎖に結合する.これに対して真核生物のSRPは,7S RNAに六つのサブユニットタンパク質が結合した複合体であり,原核細胞のそれよりも大きい構造を持つ11).そのため,新生ペプチド鎖の疎水部分に結合した後,SRPの一部がリボソームのAサイトに干渉し,翻訳反応を一時的に停止させることが知られている.原核細胞のSRPにはこれらの構造が欠損しているため,翻訳を停止させる機能はない.いずれにしろ,翻訳と共役した膜挿入のために必要な細胞質因子はSRPとSRのみであるということは,著者らの部分的再構築実験によって実証されている12).
一方,細胞膜側では,Secトランスロコンというポア(孔)構造を持った膜タンパク質複合体が,新生ペプチド鎖の翻訳と共役した膜挿入を制御している13).大腸菌の場合,SecY, SecE, SecGがメインのサブユニットタンパク質であることが知られているが,SecYとSecEのみでもトランスロコンとして機能することが知られている14).また,細胞質側に突出したSecYのTM6/7間とTM8/9間のループ部分がリボソームの大サブユニットタンパク質と相互作用することが知られている.これにより,翻訳中のリボソームが安定してSecYEGトランスロコンにつなぎとめられることがわかっている15).したがって,伸長中の疎水的なペプチド鎖は凝集するリスクを負うことなく膜に組み込まれる(図2).
さて,タンパク質の膜挿入に重要なこのSecトランスロコンであるが,無細胞タンパク質合成系により人工的に合成することが可能である16).その方法は非常に簡単で,人工的に調製したリポソームと呼ばれる脂質膜小胞を無細胞タンパク質合成系に投入し,このリポソーム存在下でSecY, SecE, SecG3種のタンパク質を同時に合成するだけである.合成されたサブユニットタンパク質は自発的に膜に挿入し三者複合体を形成する.複合体を形成したSecYEGはタンパク質膜透過のための分泌孔として機能し,分泌タンパク質であるpOmpA(precursor of outer membrane protein A)をモータータンパク質SecA依存的に,膜の反対側へ透過させた(図3).さらにこのSecYEGは,膜タンパク質の膜挿入の際のゲートとしての機能も維持しており,6回膜貫通型タンパク質であるYidCを,SecA存在下で翻訳と共役して膜に挿入させた(図3b).膜挿入反応の基質として用いられたYidCは,1番目と2番目の膜貫通領域の間にぺリプラズム側に大きく突出したループ構造を持つ.そのためYidCを翻訳中のリボソームが正しくSecYEGに結合し,かつペリプラズムループがSecAにより膜の反対側に透過されれば,YidCは膜の反対側(ペリプラズム側)にペリプラズムループを持った天然型の配向性で膜に挿入されるはずである.しかし,実際の人工膜ではSecYEGを介さず脂質膜に直接コンタクトし,制御されていない状態で自発的に膜挿入するものが多い.この場合にはループ部分が膜の反対側に透過されず,結果,逆向きの配向性で膜に挿入される(図3b).人工的な系における膜挿入効率を上げるためには,タンパク質が自発的に膜挿入しないように,膜の脂質組成を調整する必要がある.
Secトランスロコンのようなヘテロ多量体による膜タンパク質の合成と複合体形成には機能発現のための細胞膜局在ヘルパー因子が必要だと考えられていた.しかし,実際には合成されたサブユニットタンパク質が疎水的相互作用により自発的に膜挿入し,挿入先のリポソーム膜上でパートナーのサブユニットと複合体を形成することで,自発的に機能を持つ状態になることがわかった.この自発的な膜挿入は実際の細胞内では起こらないと考えられているものの,無細胞タンパク質合成系を用いて膜タンパク質を合成する際には非常に有効である.図4は人工膜であるリポソーム存在下で,6回膜貫通型タンパク質MtlA(mannitol permease)を合成し,合成後に膜外に露出した親水部分をプロテアーゼ(proteinase K:PK)で切断した結果である.PK切断で小さくなったタンパク質,MtlA-MPF(membrane protected fragment)の分子サイズは,大腸菌から調製した生体膜を使用した場合のそれと同じであった.このことから,人工膜に自発的に膜挿入したタンパク質は,生体内と同じ膜配向性を維持していることが示唆される.ただしこれには条件があり,タンパク質合成と膜挿入が共役して起こらなければならない.タンパク質合成終了後に膜を添加しても,すでに合成産物が凝集体を形成しているため膜挿入の基質になりえないからである.また,生体内と同じ膜配向性を維持した自発的膜挿入は,すべての膜タンパク質において起こるわけではない.たとえばYidCのように,膜の反対側であるトランス側の親水部分がタンパク質の構造上大部分を占めている場合,この親水部分は自発的に膜を透過することができない.この場合には先に述べたSecYEGが必要になり,このポアを通して親水部分を膜のトランス側に出す必要がある.
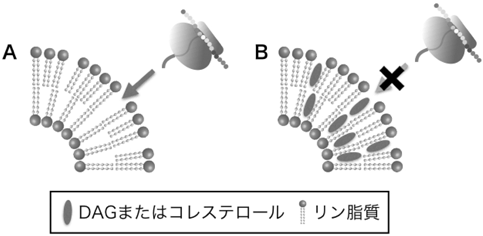
自発的な膜挿入は脂質膜と新生ペプチド鎖間の疎水的相互作用で起こると考えられている17).通常のリン脂質を用いた人工脂質膜の場合,脂肪鎖により形成される疎水部分の密度が,表面の親水部分の密度に比べて低くなるという現象が起こる.このとき,疎水的な分子が膜近傍に接近すると,ストレスのかかった低密度の疎水部分に取り込もうとする力が働くため,疎水的なペプチド鎖が自発的に膜に挿入される.人工膜の脂質に生理的濃度のジアシルグリセロール(DAG)が含まれる場合,自発的な膜挿入がブロックされる18).同じ現象が40%(mol/mol)以上のコレスレロールでもみられる.これらの分子は,親水的な部分に比べて疎水的な部分が大きいため,低密度の油部分を埋めるためには都合がいい.そのため,DAGやコレステロールを脂質組成に含む人工膜では親水的な膜表面の密度と二重膜内部の油の密度が釣り合い,自発的な膜挿入は起こらないと考えられる(図5).
細胞内でのタンパク質膜挿入過程を忠実に再現しようとする場合,自発的な膜挿入が起こらない脂質組成の人工膜にSecトランスロコンを組み込ませ,SRP/SR依存的に膜挿入する系を構築しなくてはならない.しかし,実際はこれらの因子以外にも,新規の生体分子が膜挿入に積極的に影響しているという報告がされている.たとえば,西山らは,MPIase(membrane protein insertase)と呼ばれる糖脂質が細胞膜の細胞質側に存在し,Secトランスロコンを介した膜挿入プロセスに積極的に関わっていると報告している19).MPIaseはタンパク質性の酵素ではなく,1,2-ジアシル-sn-グリセロール3-リン酸にピロリン酸を介して糖鎖が結合している構造を持つ脂質である.糖鎖部分は,水溶性であり,アセチル基を有した3種のアミノ糖からなるユニットが10回ほど繰り返された構造を持つ.MPIaseの構造機能相関を調べたところ,脂質部分を欠く水溶性の糖鎖部分は野生型のMPIaseよりも高い膜挿入活性を持っていたこと,この水溶性の糖鎖は新生膜タンパク質と直接相互作用して水溶性複合体を形成していたこと,さらにこの複合体は膜挿入活性を保持していることが判明した.この糖脂質が細胞膜上で数分子密集することで,局所的に水溶性に富んだ部分を形成し,Secトランスロコンと複合体を形成することで,膜挿入を優位に進めていると考えられる.in vitroでの細胞内タンパク質膜挿入系を再構築する場合,このMPIaseも構成因子として取り入れる必要があるだろう.
膜タンパク質合成は,翻訳反応から始まり膜へのターゲティング,膜挿入反応,膜内での立体構造形成・複合体形成と非常に多くの過程が連続的に起こるダイナミックな反応である.この一連の反応を包括的に理解するためには,無細胞タンパク質合成系を基盤とした再構築化が不可欠である.特に膜タンパク質が挿入されている“膜”の中で何が起こっているのかを詳細に理解することが重要であり,脂質レベルでの解析と,YidCやMPIase, SecDF,ペリプラズム因子など,膜挿入に関する周辺因子の寄与も明らかにしていく必要がある.無細胞タンパク質合成系による再構築化が達成されれば,生体を用いた系では調製が難しい,複雑な膜配向性を持つ膜タンパク質の試験管内合成が可能となり,創薬研究や,人工細胞研究など多くの研究分野への応用が期待できる.
3)無細胞タンパク質合成系と合成生物学
合成生物学は,構成的な手法から生命の原理解明に迫ろうとする新たな研究分野である.具体的には,生命を構成する生体高分子を組み合わせて試験管内で再構成することにより機能する生命システムを創成するボトムアップ的アプローチ,また多数の遺伝子群を導入や組み直すことにより細胞機能を大幅に操作改変するトップダウン的アプローチにより,生命システムを創ろうとする試みである.前者のアプローチでは,生命システムを集積して,人工的に細胞を創ることが大きな目標であり,今までの膨大な分子生物学的知見の蓄積とバイオテクノロジーの基盤技術の発展により実現性を帯びつつある.人工細胞の研究では,生命の基本となるシステムをリポソーム中に組み込み,細胞の機能を示すシステムを作製することが試みられている.特に,セントラルドグマを構成する遺伝子複製系やタンパク質合成系は最も生命の本質に近いシステムと考えられ,リポソームへ組み込む格好のシステムとして盛んに研究されている.複製系についてはRNAレプリカーゼを封入して遺伝情報を複製する人工細胞の構築が進んでいる20, 21).また,転写や翻訳反応のリポソーム内での再構築の報告もなされている16, 22–25).特に,再構成型タンパク質合成系であるPURE systemをリポソーム内に封入したシステムは,系内の分子を把握でき,制御も容易であるため,人工細胞の実現に最も有利なシステムと考えられている.実際に,PURE systemを用いることにより,ATP合成酵素を発現させ細胞のエネルギーであるATPを生産するリポソームや,分泌タンパク質や膜タンパク質の転送装置であるトランスロコンを有するリポソームの創出が報告されている16, 26).
こうした合成生物学での人工細胞を創る試みにおいては,生命の最も重要な特質の一つである「増殖」の特性を有する生命システムの創出がブレイクスルーになる.生命システムが遺伝情報に変異を生じながら増殖することにより,生命にとって重要なもう一つの特質である外界に対応した「進化」も可能となる.増殖する生命システムの実現には,PURE system自体の増殖も必要不可欠である.PURE systemは,開始因子,伸長因子,終結因子などの翻訳因子と,リボソーム,遺伝暗号の構成に必要なtRNAセットを含む無細胞タンパク質合成系である.この中で,翻訳因子はPURE systemでDNAから生産(増殖)可能であるが,リボソームとtRNAをDNAから無細胞的に生産することは現時点では達成できておらず,次の克服すべき重要課題となっている.本稿ではその実現へとつながる近年の研究について紹介する.
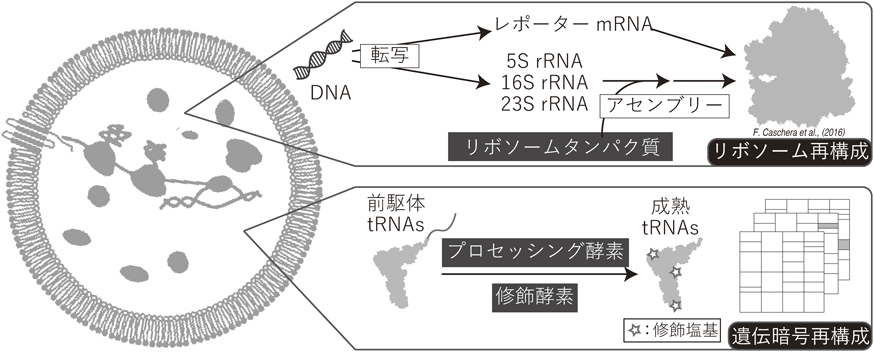
リボソームについては立体構造こそ解明されたが,その細胞内での生合成過程についてはまだ十分な理解には至っていない.1960年代から70年代にかけて,細胞から調製したリボソームからフェノール抽出や密度勾配遠心法を用いて単離したrRNAと,リボソームから解離させたリボソームタンパク質を試験管内で混合させることでリボソームの再構成が可能であることが示された27, 28).それらのリボソームの試験管内再構成実験によって作製されたアセンブリーマップは,リボソームの生合成過程の解明に糸口を与えたものの,非生理的な高塩濃度・高温条件下で行った実験をもとにしているために,必ずしも生合成過程を反映しているとはいえない.近年になって,生理的条件下で,タンパク性因子存在下でリボソームを試験管内で再構成する試みが行われている.Jewettらは,リボソームを除いた細胞抽出液(S150)内で転写されたrRNAとリボソームから解離させたリボソームタンパク質画分から,翻訳活性を有するリボソームが生理的条件で再構成できることを示した(iSAT法)29).また,このリボソーム再構成系をリポソームに封入しても動作することも確認している30)(図6).この抽出液中にはリボソームの生合成に関与する因子,たとえばrRNAの修飾酵素やシャペロン等が含まれている.そのため生理的条件でのリボソームの再構成が可能となったと考えられる.しかしながら,再構成リボソームを用いたタンパク質合成量は天然のリボソームをそのまま系へ添加した場合と比較して顕著に低く,今後のさらなる改良が必要とされる.より活性の高いリボソームの再構成を可能とするためには,細胞内での生合成プロセスを無細胞で再構成することが必要不可欠であろう.著者らはリボソーム小サブユニットについて,調製された生合成因子群の存在下,個々に精製したリボソームタンパク質とリボソームから調製した16SrRNAとを混合することで,生理的条件で活性を有する小サブユニットの再構成に成功した(未発表).大サブユニットについても同様の生合成系の再構成ができればリボソームの全生合成が可能となり,PURE systemの増殖の実現につながる.
PURE system中のtRNAの増殖についても実現しなくてはいけない.PURE systemに含まれるtRNAは,大腸菌からフェノール抽出し調製したものである.それらのtRNA画分の代わりに試験管内転写されたtRNAセットでタンパク質合成が可能であれば,DNAとRNAポリメラーゼからtRNAセットの増殖が可能となる.現在,研究に広く用いられているのはT7 RNAポリメラーゼなどの転写酵素を用いてin vitroで転写合成したtRNAであるが,こうした転写酵素が入手可能となったのは1980年代後半である.1960年代から1970年代はtRNAの化学的全合成も可能ではあったが,手法の煩雑さからか広く使用されず,バクテリオファージ等を用いた遺伝学的な手法によりtRNAの機能が研究されてきた31).1980年代になると精製されたRNAポリメラーゼを用いてDNAからtRNAを試験管内転写させる方法が確立され,アミノアシルtRNA合成酵素のtRNA認識を中心とした機能構造相関の研究が活発に行われるようになった.2000年代になると転写されたtRNAを用いて,非天然アミノ酸を含むアミノ酸21種類が割り当てられた遺伝暗号や32),アミノ酸16種類のみがすべてのセンスコドンに割り当てられた単純な遺伝暗号も構成可能であることが示された33).近年では,無細胞タンパク質合成系により,修飾塩基を含まない転写tRNAを用いた20種類のアミノ酸の解読が可能な遺伝暗号の再構成が報告されるようになった.2015年にはAlexandrovらが,天然より抽出した3種類のtRNAと試験管内転写したtRNAセットによる無細胞タンパク質合成系を構築し34),2016年には菅らが試験管内転写されたtRNAのみを用いて,20種類のアミノ酸に加え,非天然アミノ酸を含むペプチドを翻訳可能である遺伝暗号を再構成している35).これらの研究の先にあるのは,すべてのセンスコドンが試験管内転写されたtRNAセットのみで翻訳される遺伝暗号の再構成である.転写tRNAのセットでタンパク質合成が可能であれば,DNAとRNAポリメラーゼによりtRNAの増殖が可能となる.しかし,これらの転写されたtRNAは修飾塩基を含まないため,天然tRNAと比べてタンパク質合成の効率や正確性の点で大きく劣る.改良するためには,天然のtRNA配列を単に転写するだけではなく試験管内での修飾酵素による塩基修飾の導入や塩基配列の一部を変更するなどの工夫が必要とされるだろう(図6).
無細胞タンパク質合成系は,ボトムアップ的アプローチの合成生物学の基盤的な技術である.合成生物学の大目標である人工細胞の実現に到達するためには,リボソームの試験管内再構成系の構築やtRNAセットによる遺伝暗号の再構成とともに,DNA複製や細胞分裂といった生命システムの再構成も必要であるが,それらは部分的な再構成が可能となってきている36).このようにして,生命の特性である翻訳・分裂・複製・代謝といった生命システムの再構成が可能となり,各要素の集積が可能となれば,生命の多様な機能を有する人工細胞の創成が実現できるであろう37).そのためには,ここで紹介したような生体高分子を組み合わせて生命システムを再構成する,ボトムアップ的な研究の基盤技術の高度化と同時に,ゲノム情報に基づくトップダウン的な研究も相補的に行っていくことが必要であろう38).
1)創薬ターゲット膜タンパク質の合成とスクリーニングへの利用
膜タンパク質は生体内のタンパク質のおよそ30%を占め,ヒトでは5000種類以上存在すると考えられている.その機能はリガンド結合によるシグナル伝達やイオンチャネルなど多岐にわたり生命活動において数多くの重要な役割を果たしていることから,膜タンパク質の機能不全はさまざまなヒト疾患の原因となる.実際,現在の創薬ターゲットの半数以上は膜タンパク質であり,膜タンパク質を対象とした研究は,生理機能の解明にとどまらず創薬に結びつく可能性が高い.たとえば,ヒトのGタンパク質共役受容体(GPCR)は800種類以上あり,GPCRの機能を制御する化合物や抗体は有力な新薬候補となりうる.今後も創薬ターゲットになる膜タンパク質の数は増加していくと思われる.
しかし,膜タンパク質の調製は簡単ではない.大腸菌など生体を用いた発現系では細胞毒性がネックとなり大量発現できないことが多いし,発現できたとしても疎水性ドメインを有するために単独では容易に凝集沈殿してしまう.そこで近年,上述したような無細胞タンパク質合成系を用いた膜タンパク質の合成系が考案され,これまで取得が困難であった膜タンパク質の大量合成が可能になった.反応系にBrij-35やDigitoninのような界面活性剤を加えるか,リポソームやナノディスクなどの人工脂質膜を共存させることで,膜タンパク質を可溶性タンパク質として発現し,機能解析や構造解析もできるようになってきた39).また,最近では機能構造解析だけでなく,創薬スクリーニングなどの応用研究にも用いられるようになっている.
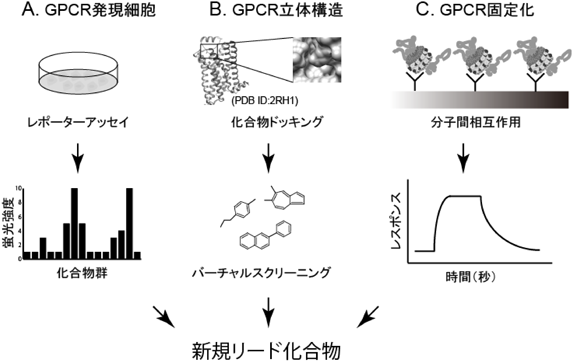
これまでの創薬スクリーニングでは,標的の膜タンパク質を発現している細胞や膜画分に対して化合物ライブラリーを用いたスクリーニングが行われてきた40)(図7A).しかしながら,この手法では標的の膜タンパク質以外にも多くの膜タンパク質が混在しているため偽陽性が生じるリスクが高い.それに対して無細胞タンパク質合成系を用いて標的の膜タンパク質を合成すれば,標的タンパク質のみを含む膜画分を単離することが可能であるため,スクリーニング効率が上がることが期待できる.また,GPCRの構造解析を通してドッキングする化合物のデザインなども可能になる(図7B).あるいは,標的のGPCRが挿入された人工脂質膜をセンサーチップに固定化して表面プラズモン共鳴(SPR)法による化合物リガンドのスクリーニングも可能である(図7C).無細胞タンパク質合成系は,生細胞を用いた発現系に比べて短時間で多検体の発現が可能であることから,ハイスループットなスクリーニングにも向いている.
低分子化合物のスクリーニング目的だけでなく,抗体調製のための抗原としての膜タンパク質の合成にも無細胞タンパク質合成系は使用できる.たとえば,愛媛大の澤崎らはコムギ胚芽抽出液を利用して合成したGPCRが挿入されたプロテオリポソームを抗原としてマウスやウサギに免疫を行い,親和性の高いモノクローナル抗体を得ることに成功している41)(図8).リポソームに挿入された膜タンパク質は,機能を発揮しやすいだけでなく免疫注射後の生体内における安定性も高いため,抗原として使用するのに有効である.
2)in vitroディスプレイ
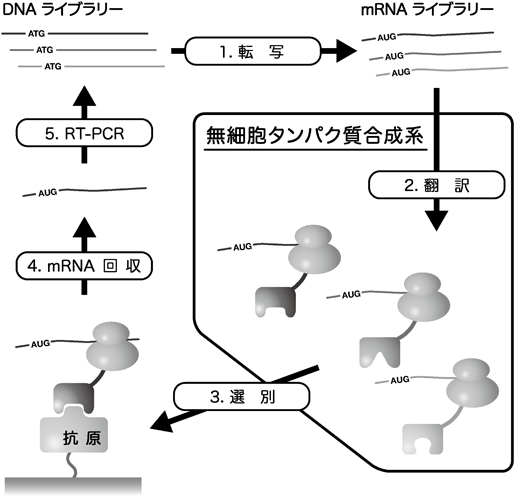
近年,無細胞タンパク質合成系を利用して,1010種類という大きな遺伝子ライブラリーから有用なペプチドやタンパク質をコードする遺伝子を選択する,リボソームディスプレイ42)やmRNAディスプレイ43)などのin vitroディスプレイ法が開発された.in vitroディスプレイは,遺伝子とその産物であるタンパク質とを1対1に関連づけた後,タンパク質の性質(結合活性,酵素活性など)により選別し,遺伝子を回収する方法である.たとえば,リボソームディスプレイは,リボソーム上で翻訳反応を一時中断させることにより,mRNA,リボソーム,合成途上ポリペプチド(タンパク質)からなる三者複合体を形成させて遺伝子とその産物を1対1に関連づけた後,この三者複合体を一つの分子としてみなして選別するディスプレイ法である(図9).リボソームディスプレイは,細胞抽出液を使用する無細胞タンパク質合成系を用いて開発されたが,反応液内に存在するRNaseによるmRNAの分解や複合体の安定性の問題などがあった.一方,PURE systemにはRNaseなどの翻訳を阻害する因子や翻訳に関与しない因子はほとんど含まれていないため,他の無細胞タンパク質合成系よりも効率よくリボソームディスプレイを実施できることが示されている44–46).in vitroディスプレイを用いることで,特定のタンパク質に結合するペプチドや抗体分子を選択することが可能である.たとえば,膜タンパク質のペプチドリガンド同定にも利用できる.ヒトのGPCRのうち,100種類以上は結合するリガンドが不明のオーファンGPCRである.ペプチドがリガンドであるGPCRについては生体抽出液からペプチドを精製することによりリガンドが同定されてきたが,この手法では発現量が少ないペプチドリガンドや安定性が低いペプチドリガンドを同定するのが困難だった.実際,近年は新たなペプチドリガンド同定の報告はほとんどない.in vitroディスプレイによりオーファンGPCRに結合するペプチドを同定できれば,同定した結合ペプチドを代理リガンドとして使用して機能解析やペプチド創薬につなげることも可能である.
また,リポソームディスプレイという手法は,リポソーム内でPURE systemにより合成された膜タンパク質がリポソーム膜上に挿入されて機能を発揮することを利用したin vitroディスプレイ法である.阪大の四方,松浦らは,この手法を用いてα-ヘモリシンという生体膜に穴を開ける活性を有する膜タンパク質の機能進化を行った.α-ヘモリシンの遺伝子に変異を入れた100万種類の遺伝子ライブラリーを作製し,リポソーム内で単一の遺伝子から合成すると,合成産物の活性に応じてリポソーム膜に穴が生じる.外から蛍光物質を与えると活性の高いα-ヘモリシンはより多くの蛍光物質を取り込むことを利用して,高機能のα-ヘモリシンを発現しているリポソームをセルソーターにより選択した.その結果,野生型の約30倍の活性を有する進化型ヘモリシンを取得することに成功している47).このように試験管内で膜タンパク質を進化させる手法は将来的に環境物質や光などさまざまな要因に対する高感度センサーの開発に応用できる可能性がある.
3)非天然型アミノ酸を導入した人工タンパク質の合成
1989年に,アンバーサプレッションを利用して,天然のリボソームでは使用されていない非天然型アミノ酸を部位特異的に導入したタンパク質を合成する技術が開発された48).この技術は,i)非天然型アミノ酸を導入したい部位のコドンを終止コドンの一つであるアンバーコドン(UAG)に置換した目的タンパク質の遺伝子,およびアンバーコドンに対応させたアンチコドンを持つtRNAを希望する非天然型アミノ酸でアミノアシル化したサプレッサーtRNAを用意し,ii)これらを無細胞タンパク質合成系に添加して合成することにより,希望する非天然型アミノ酸を部位特異的に導入したタンパク質を合成することができるというものである.この技術は,もともと大腸菌などの細胞抽出液を利用した無細胞タンパク質合成系を使用して開発された48).しかし,野生型の大腸菌の細胞抽出液を用いた場合,アンバーコドンを認識するペプチド(鎖)解離因子(RF1)が存在するために,アンバーコドンで翻訳が終了した短いポリペプチドも合成されてしまう.そのため,希望する非天然型アミノ酸を含むタンパク質の合成効率が低下してしまうという欠点があった.一方,PURE systemでは,前述のように特定の因子を含まない反応系を容易に調製することができるため,RF1を含まないPURE systemを利用すれば,アンバーサプレッションも効率よく行うことができる6).この技術を拡張すると,本来アミノ酸を指定している61個のセンスコドンについても,新たなアミノ酸を指定することが可能である.たとえば,菅らのグループは,彼らが開発したアミノアシルtRNA合成活性を有するリボザイムと,PURE systemを組み合わせることによって,特定のセンスコドンに非天然型のアミノ酸を対応させたペプチドを合成することに成功している49).