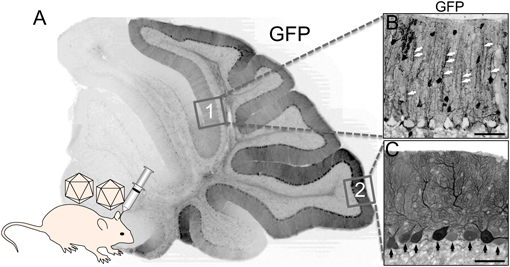
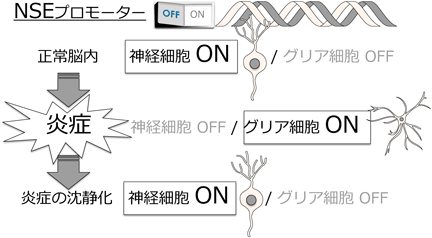
“ニューロン特異的エノラーゼ(NSE)”は炎症があるとニューロンではなくグリア細胞で産生されるProduction of the neuron-specific enolase in astrocytes, but not in neurons, under the neuronal inflammation
群馬大学大学院医学系研究科・脳神経再生医学分野Department of Neurophysiology & Neural Repair, Gunma University Graduate School of Medicine ◇ 〒371–8511 群馬県前橋市昭和町3–39–22 ◇ 3–39–22 Maebashi, Gunma 371–8511, Japan